lncRNA与癌症
癌症相关的lncRNA研究是进展最快,成果最丰富的新兴领域。研究者利用Arraystar LncRNA芯片对不同癌症的鉴别、发生、发展、恶化、转移等现象进行较多的深入研究,为其他领域的lncRNA研究建立完善的方法学体系指引了研究方向。
人类基因组能够产生10000多种长链非编码RNA(lncRNA),但是至今为止,人们只知道几十种lncRNA分子的功能。癌细胞基因组非常混乱,且常常出现拷贝数变异(somatic copy-number alterations,SCNAs)。虽然大多数拷贝数变异都是基因组不稳定造成的,但有一少部分SCNAs会致癌。使用大规模基因组图谱和全基因功能筛选已经可以发现致癌的蛋白编码SCNAs。但是,人体内蛋白编码序列很少,癌细胞中许多SCNA都在非编码区域。
有很大比例的lncRNAs 都与染色质(DNA-蛋白质复合物)调控因子有关,其中有一部分通过调节相关基因表达的特异染色质标记物,对特定的染色体区域进行“标记”。lncRNAs 和转录因子之间相互联系可以编程分步骤对转录因子进行化学修饰,使得增强子向靶基因提供连贯的信息流。这些研究结果还加强了关于lncRNAs介导增强子-启动子成环机制的认识。RNA介导的蛋白质招募要求一种对启动子相关组蛋白标记具有亲和力的蛋白质,位于增强子元件末端,可以稳定DNA成环,促进三维空间信息的沟通。这意味着lncRNAs不仅仅是简单的支架,它更像是一个复杂的计算机电路板,连接各种不同的分子元件,并指挥系统的逻辑运算。
近期的研究发现,人类癌症过程中有许多的 lncRNAs失调,了解这些转录物是如何生成的以及调控机制对于该领域的研究非常重要。复杂的RNA机制旨在促进以癌症的诊断和预防的目的的RNA工程技术的发展,而不是简单地对于lncRNA水平进行调控。
下面就介绍几个与肿瘤相关的lncRNA。
1 H19
H19 是第一个被发现的非编码RNA 基因,它在多种癌症中如食道癌、结肠癌、肝癌、膀胱癌和转移性肝癌等都异常表达。但是H19具有癌基因和抑癌基因的双重功能。比如在肝癌、前列腺癌中H19表达量升高,发挥了类似于癌基因的作用;在结肠癌细胞株和原发性结肠癌中,H19 作为miR-675 的前体,表达量上调。miR-675具有下调抑癌基因RB表达的作用,因此H19在结肠癌细胞株和原发性结肠癌中发挥了癌基因的作用。相反,在对结肠癌、畸胎瘤、肝癌等模型的研究中发现,缺少H19可促进肿瘤的发生或肿瘤的增大,这显示H19在肿瘤中起抑癌基因的作用。最新的研究显示,P53,HIF1-α和H19 之间存在相关性。实验显示,体外过表达HIF1-α和同时抑制P53 基因表达可协同提高肿瘤细胞中H19的表达水平;且在P53 突变型细胞或无P53的肿瘤细胞制备的移植瘤体内,H19的表达水平同样显著提高。H19作为癌基因还是抑癌基因的差异主要是由于lncRNA 的双功能的自然特性或可能依不同的背景而定,然而H19准确的功能和生物学作用仍有待进一步确定。
2 HOTAIR
HOX 基因的反义基因间RNA( HOX antisense intergenic RNA,HOTAIR) 是一个长度为2.2 kb 的基因,定位在哺乳动物12q13. 13 上HOXC位点,不编码任何蛋白质。这个非编码RNA在原发性和转移性乳腺癌中显著上调,高出正常乳腺组织2000倍,而且HOTAIR 的表达与肿瘤转移和预后有关。同样的,与正常非癌变的结肠组织比,HOTAIR在结肠癌组织中的表达量增加,而且高表达HOTAIR的病人预后差。有研究表明,HOTAIR与哺乳动物多梳蛋白抑制性复合物2( PRC2) 密切相关,而PRC2介导了发育过程中控制分化的几千个基因的转录表达。HOTAIR可至少连接两个不同的组蛋白修饰复合物,从而充当一个脚手架的作用,如其5’端区连接PRC2 复合物,负责H3K27 的甲基化;3’区连接LSD1(组蛋白赖氨酸去甲基化酶)介导H3K4me2 的去甲基化。最近,Chou等通过RNA纯化染色体分离结合测序技术研究发现,HOTAIR能与更广泛的PRC2 和H3K27连接,表明HOTAIR 同染色体的相互作用与PRC2 的重定位和基因沉默相关。目前,尽管HOXAIR 重编程染色体状态而启动癌症的转移是清楚的,但是HOTAIR 活性的准确作用机理仍有待阐明。
3 MEG3
母系表达基因3 ( materally expressed gene 3,MEG3) 是第一个被发现有肿瘤抑制功能的lncRNA。MEG3是由10 个外显子组成的单拷贝印迹基因,到目前为止,由于不同的剪接方式共发现12 个MEG3表型,每个表型包含共同的外显子1-3 和8-10。而外显子4-7 则有不同的链接方式;同时,MEG3 基因的最后几个内含子可编码miR-770。在结构上,12个不同表型的MEG均具有3 个明显的二级结构域。功能上,MEG3能与cAMP、P53、鼠双微基因2( MDM2)和生长分化因子15 相互作用,MEG3 作为调控性RNA 可通过依赖性和非依赖性P53 而起作用。MEG3本身的表达受表观遗传学的控制,在多种癌症类型中MEG3 存在异常CpG 甲基化。MEG3 表达于多种正常组织中,特别在脑组织呈现高表达,然而,在脑癌及一些肿瘤细胞株中不表达,说明MEG3 具有肿瘤抑制因子的作用。Zhang等报道,MEG3 与脑膜瘤的病理发生、临床进展相关,在正常脑膜细胞高表达,而在大多数人脑膜瘤组织或细胞株中不表达,同时MEG3 表达的缺失与肿瘤的分级存在强烈的相关性。最新研究显示,MEG3 与神经胶质瘤增殖相关,MEG3 的异位过表达抑制细胞增殖,诱导细胞凋亡。从功能上看,MEG3 抑制脑膜瘤细胞的DNA 合成及细胞集落的形成,而且刺激P53 介导的转录活化。在对多发性骨髓瘤、急性髓性白血病、骨髓增生异常综合症病例MEG3 基因启动子差异性甲基化区的甲基化状态分析发现, 57%的多发性骨髓瘤存在异常的甲基化谱,并且甲基化谱与疾病的亚型和疾病的阶段具有相关性,同时发现, 34.9% MDS和47.6%的急性骨髓性白血病有异常甲基化,但在甲基化状态与核型、疾病亚型和预后评分系统间没有重要联系。目前,MEG3在细胞生物学上的重要性及在肿瘤发生的作用还在不断研究中。
4 MALAT1
肺腺癌转移相关转录因子1 ( metastasis-associated lung adenocarcinoma transcript 1,MALAT1)广泛表达于正常人组织、成年人脑组织中,且呈现高水平表达,敲除小鼠成神经瘤细胞株的MALAT1 基因后影响了神经原轴突与树突发育相关的基因的表达,提示MALAT可能与神经系统的发育有关。有报道指出,在多种人肿瘤包括前列腺癌、结肠癌、肝癌、子宫癌中MALAT1 表达上调。Xu等发现在结肠癌病人中MALAT1 的3'末端存在突变,而MALAT1的一个重要生物功能域就定位在此突变区。另有研究者通过qRT-PCR对9例肝癌细胞株和112 例肝癌病例包括60例已获得肝移植的病例进行了MALAT1表达分析,他们发现无论在癌细胞株还是临床病例中,MALAT1的表达均上调,而且在MALAT1高表达的病例中,肝移植后的病例也更易复发,因此经多研究分析,MALAT1可作为预测肝癌复发的一个重要生物标志。同时,在HepG2 细胞中,抑制MALAT1表达能有效降低细胞活力、流动性和侵袭力,并增加细胞对凋亡刺激的敏感性。研究还发现高水平MALAT1与转移密切相关,多项研究提示MALAT1调控细胞的流动性。例如沉默MALAT1表达将阻止肺腺癌细胞体外的迁移,减少宫颈癌细胞的增殖和侵袭潜力。
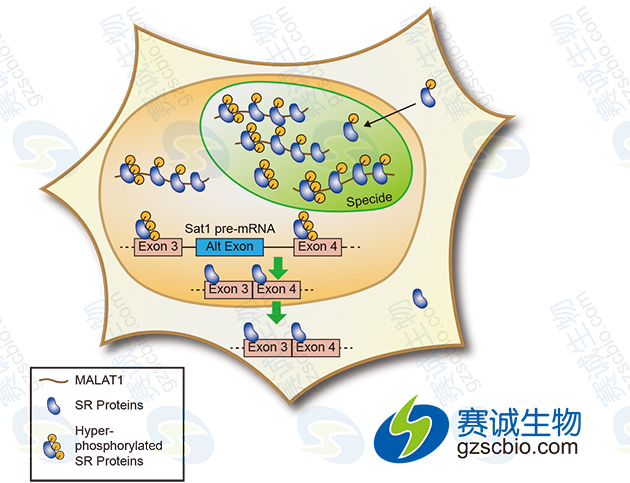
图1 LncRNA MALAT1通过调节SR剪接因子的磷酸化调控可变剪接
5 ANRIL
ANRIL是细胞周期激酶抑制因子4b( INK4b) 位点的反义非编码RNA ( antisense non-coding RNA in the INK4 Locus),其表达与INK4a的表观遗传学沉默相关。INK4b-ARF-INK4a 位点在调控细胞周期、细胞衰老、干细胞的自我更新和调亡中具有重要的作用。ANRIL的异常表达和单核苷酸多态性与包括癌症在内的一些疾病有关。而且,INK4b-ARF-INK4a在白血病、黑色素瘤、肺癌和前列腺癌等多种肿瘤中易发生缺失和高甲基化。另有证据表明ANRIL是介导INK4b-ARF-INK4a沉默的机制之一。像HOTAIR 连接PRC2 和LSD1 复合物一样,ANRIL可连接两个多梳抑制复合物PRC1、PRC2,从而导致ANRIL/PRC 介导INK4b-ARFINK4a基因沉默,然而,需要进一步阐明的是ANRIL与染色体调控因子是如何相互作用的。
随着人们对lncRNA 在肿瘤发生中作用的认识,人们开始着手开发以lncRNA 为靶点的新药。尽管对lncRNA 作用的分子机制的认识还相当有限, lncRNA 有可能成为临床肿瘤治疗的理想靶点。