miRNA的一般研究策略
miRNA也称微RNA、microRNA,是真核生物中广泛存在的一种长度为21-23nt的RNA分子,可通过与mRNA的结合,抑制mRNA的转录,因此在基因表达调控、细胞周期、生物体发育时序等方面起重要作用。
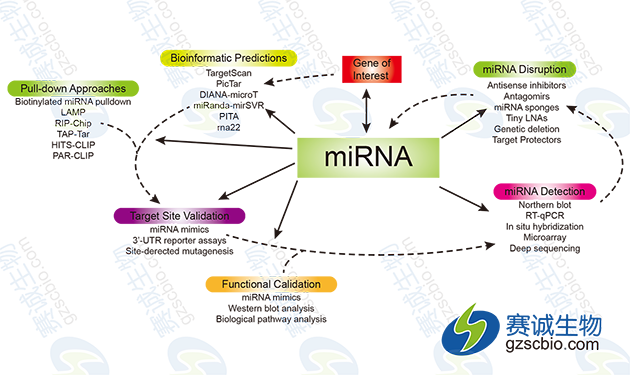
图1 miRNA的一般研究策略及相关实验手段
1 生物信息学预测靶基因
要对miRNA进行研究,首先需要采用生物信息学的方法预测miRNA的靶基因位点,即被miRNA基因沉默的作用部位。如TargetScan algorithm、PicTar algorithm、DIANA-microT algorithm、miRanda algorithm、PITA和rna22 algorithms。
2 靶基因的预测结果确认
进行靶位点预测之后,接着是要通过miRNA pulldown方法,识别靶基因位点。其中,有以下三种常用的pull-down方法:
(1)生物素化的miRNA pull-down(biotinylated miRNA pull-down)。通过生物素标记的合成miRNA转染细胞,孵育后裂解细胞,用链霉亲和素包被磁珠吸附筛选miRNA及其作用的mRNA。

图2 生物素化的miRNA pull-down
(2)标记的miRNA pull-down(labeled microRNA pull-down assay,LAMP),通过用地高辛(DIG)标记的pre-miRNA寡核苷酸与细胞提取物混合孵育,用抗地高辛的抗体做免疫共沉淀(IP),获得被共沉淀的mRNA。
(3)核蛋白免疫共沉淀-RNA高通量测序(Ribonucleoprotein immunoprecipitation followed by microarray chip analysis,RIP-Chip,RIP-seq),通过用合成的miRNA转染细胞,孵育后裂解细胞,用特异的抗AGO2抗体对RISC进行免疫共沉淀,对获得的mRNA进行microarray分析。
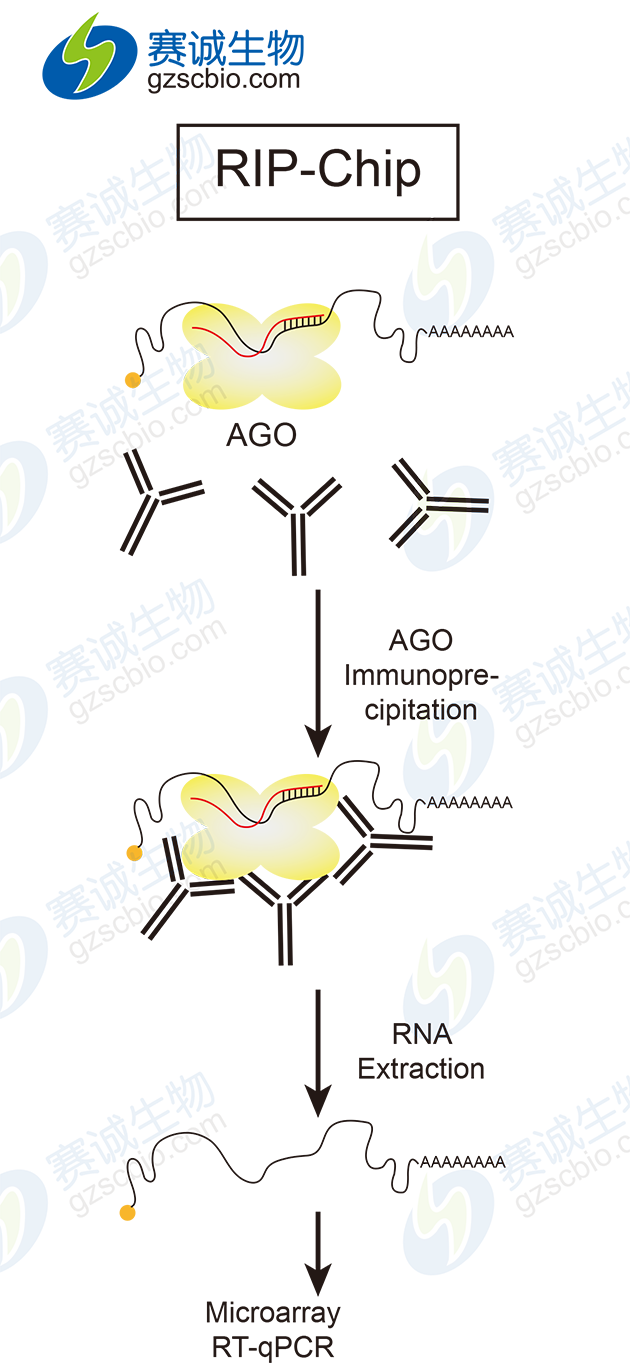
图3 RIP-Chip基本实验流程
3 miRNA的直接功能确认
通过实验方法验证miRNA是否能特异结合靶mRNA并特异抑制其表达。
(1)3’-UTR reporter assay
通过在报告基因如荧光素酶CDS的下游3’-UTR区域插入待确认的目的基因,克隆到载体如psiCHECK-2上,载体转染细胞,再用miRNA进行处理,如果目的基因上含有靶位点,则荧光素酶的转录受到抑制不发荧光。
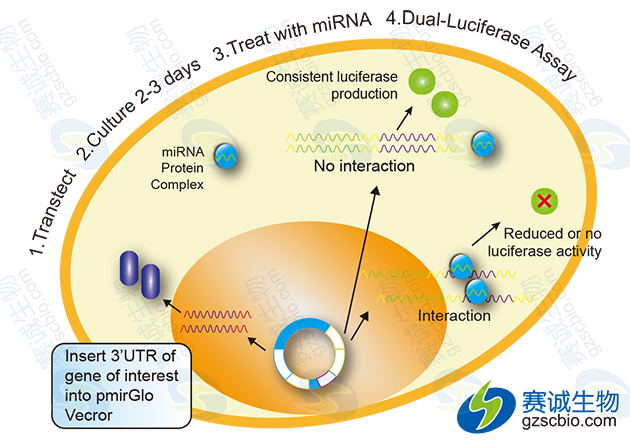
图4 3’-UTR报告基因基本实验流程
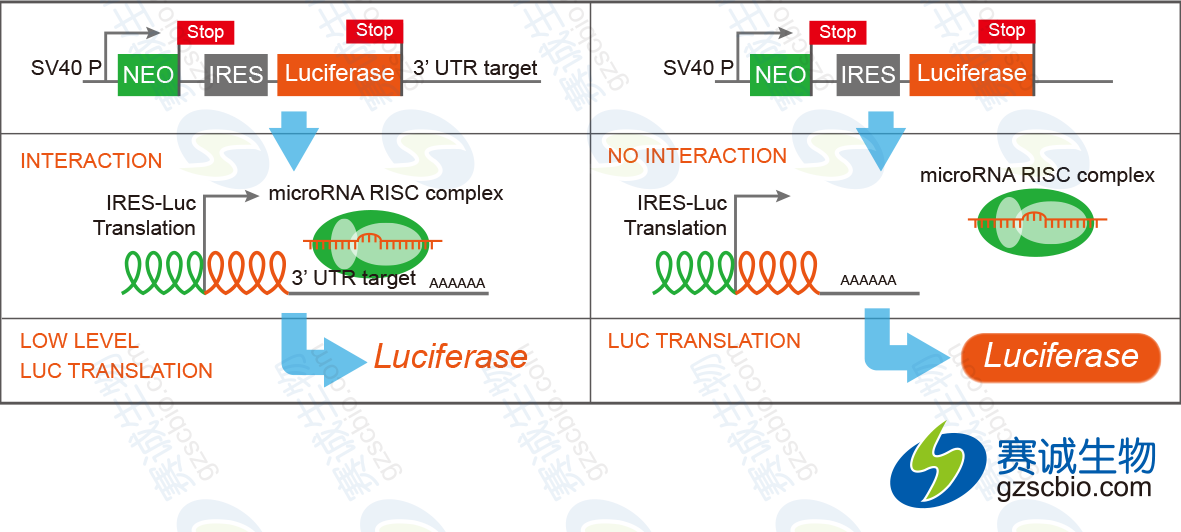
图5 3’-UTR报告基因验证miRNA直接作用情况
(2)miRNA的上调与下调
通过人工合成miRNA模拟物(miRNA mimics)或miRNA抑制物(miRNA inhibitor),增强或抑制miRNA的抑制效果,并与对照相比。
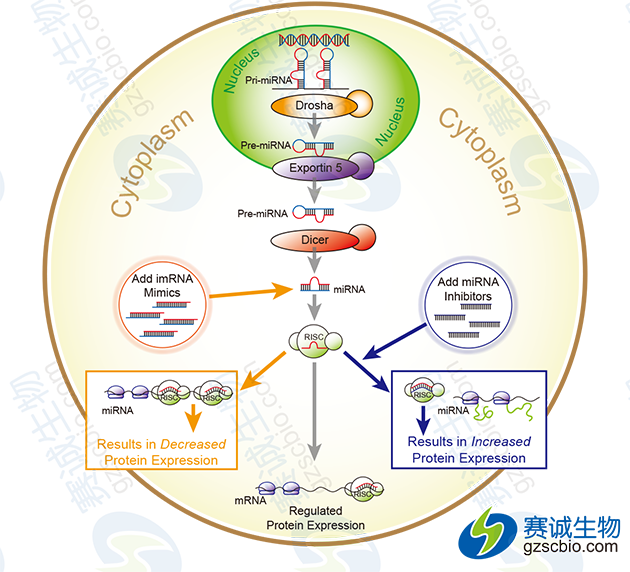
图6 miRNA的上调与下调验证miRNA直接作用情况
(3)位点定向突变(site-directed mutagenesis)
首先,将待测基因反转录为cDNA,通过用致突变的引物对cDNA模板进行重叠PCR扩增;然后,用相关的酶(一般为Kinase-Ligase-DpnI)对cDNA模板进行消化,克隆到报告基因载体;最后,将构建好的克隆转染至细胞,检测报告基因的表达。若表达显著下降,可表明靶位点定位准确。

图7 位点定向突变基本实验流程
4 miRNA的整体功能验证
对miRNA的上调/下调,通过Western Blot或其他生物学通路分析实验,探究miRNA最终是如何影响细胞、疾病等等情况。
5 miRNA的定量和定位
通过RT-qPCR、原位杂交(in situ hybridization)、microarray等实验手段,确定miRNA的具体表达量及其所在位置,以明确补充其机理研究。