miRNA的生物发生
目前,动物miRNA的生物合成、加工、运输和作用原理已经初步阐明。
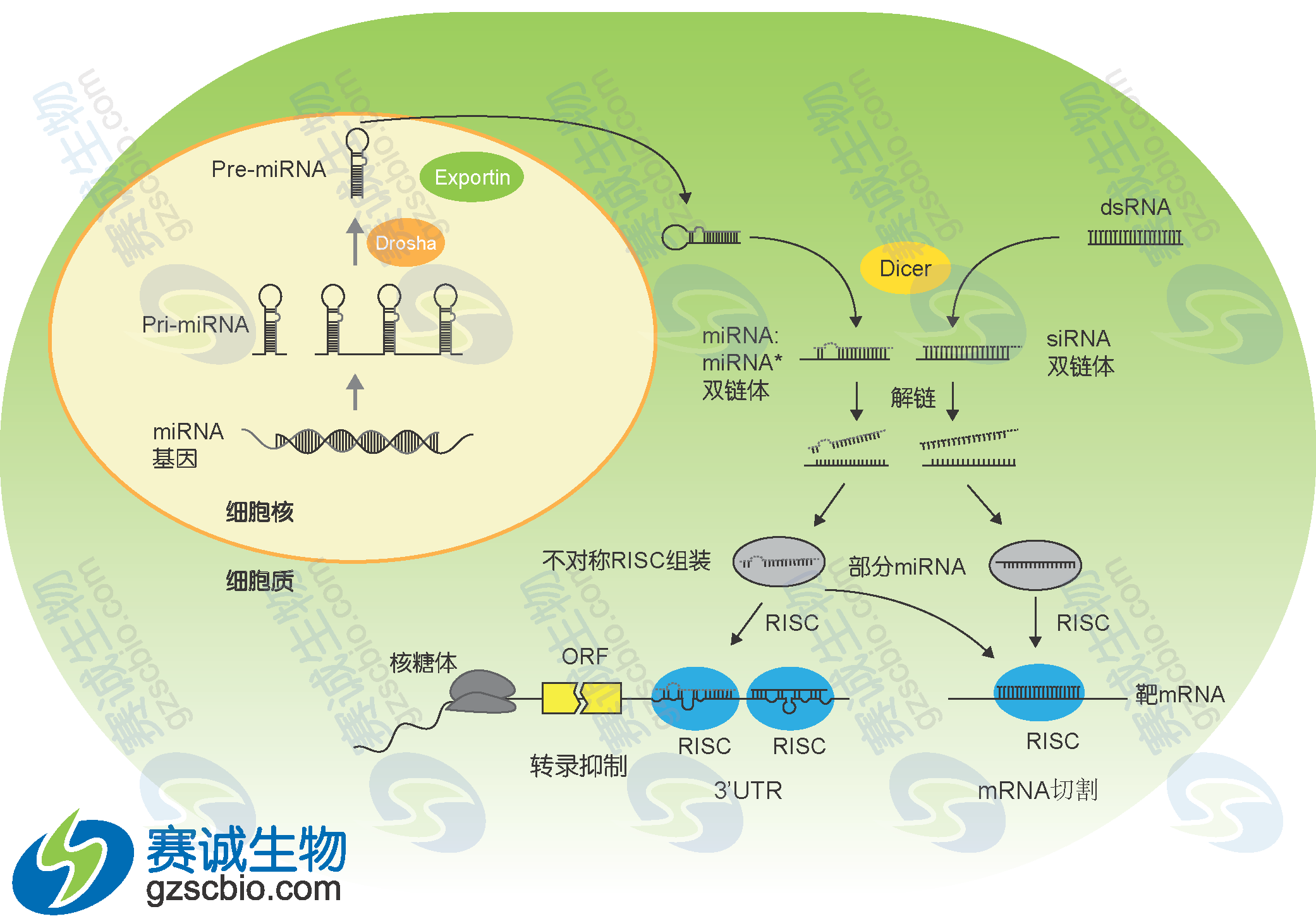
图1 miRNA产生过程模式
图1为miRNA生产过程的示意图。首先,在RNA聚合酶作用下细胞核中编码miRNA的基因转录生成长度约为几千个碱基的初级转录本pri-miRNA。Pri-miRNA在5’端具有甲基化的鸟嘌呤,而3’端具有多聚腺嘌呤碱基,同时具有一个或几个局部的发夹状结构,以多顺反子形式存在。并且,α-amanitin 可以抑制这一转录过程。有一部分miRNA的转录是由RNA 聚合酶II所完成的。Pri-miRNA的进一步加工主要在micro processor的蛋白复合体完成。这个大小约为 400-500 kDa大小的复合体主要由Drosha和Pasha两个蛋白组成。其中Drosha为一种 RNase III蛋白,而Pasha则是一个双链RNA结合蛋白(double-stranded RNA binding protein),参与 Drosha 对底物的识别。Pri-miRNA在Drosha的作用下,进一步被加工成含有60-70 nt具有茎环结构的miRNA 前体(pre-miRNA)。Pre-miRNA在RanGTP/Exportin-5转运蛋白的协助下从核内转运到细胞质中。在细胞质中,pre-miRNA被Dicer识别,并通过对茎环结构的剪切和修饰,在细胞质内形成 miRNA:miRNA*二聚体。miRNA:miRNA*二聚体在解旋酶作用下,最终生成成熟的、具有功能单链 miRNA,并随之和miRNP(miRNA ribonucleo proteins)复合体结合,而miRNA*则被迅速降解。
1 miRNA的生物合成

图2 细胞中miRNA的合成
Drosha与其他分子一起形成“微处理器复合体(microprocesssor complex)”,从而发挥分子尺的作用,判断pri-miRNA中的切割位点。在这个复合体中,Drosha与其辅酶因子DGCR8或Pasha(选择主要取决于物种)相互作用。与Drosha一样,DGCR8或Pasha同样能够在dsRNA结合结构域(dsRBD)的作用下与sdRNA相结合。一个典型的多细胞动物的pri-miRNA包含一个33bp长的茎环结构、一个末端环状结构及一个ssRNA侧翼片段(flanking segment)。这个侧翼片段对于pri-miRNA与DGCR8因子的结合非常重要,而33bp长的茎环结构对于它们的有效结合同样意义重大。Drosha蛋白可以利用微处理器复合体这种“切割前”复合体短暂地与dsRNA的茎环结构相互作用,而蛋白的酶切作用中心位点位于ssRNA与dsRNA交界处长11bp的一段序列中,在该位点切开之后会形成交错配对的切口,生成长约65-70bp的pre-miRNA。这种情况下,DGCR8蛋白可以发挥分子尺的作用,“测量”ssRNA与dsRNA交界处的长短。微处理器复合体很有可能通过识别ssRNA末端的环状结构找到RNA,然后在另一端与其茎环结构相结合。在这种情况下,可能会在一段靠近RNA末端环状结构的长约11bp的可变区域里发生不完全剪切。不过,绝大部分的pri-miRNA分子内部都含有突出结构,或者配对不十分匹配的区域,而这段区域也都是位于离末端环状结构大约11bp处,因此这就能够避免在该处发生错误切割的问题。
最近发现,有很多编码这种miRNA的基因都位于内含子区域,对这类miRNA的处理是不需要Drosha酶参与的,而是直接通过剪接体(spliceosome)来完成。这些内含子miRNA(也被称作mirtron)3’端的茎环结构和一个细小的、已注释的内含子3’端的剪接位点的剪切机制与核内pre-mRNA的间接机制相同,所以无需Drosha酶的参与。接下来,以套索形式被剪接体释放出来的mirtron前体分子会在去分支酶(debranching enzyme)的作用下线性化。随后,它们模拟pre-miRNA的发夹结构直接进入miRNA处理程序,继而被转移至胞质被Dicer酶处理,而不是被Drosha酶剪切。
由于Dicer酶和Drosha酶缺乏剪切精确性,因此可能会生成一系列5’端和3’端各异的miRNA-miRNA*双链产物。在动物细胞中,大部分miRNA都会与目的mRNA形成配对不十分精确的杂交双链。这种配对的精确性绝大部分都是由miRNA分子的5’端的第2-8位序列来提供的,这段序列也被称做种子区域。Dicer酶和Drosha酶不精确的剪切既有可能改变种子区域,也有可能颠覆双链分子5’端和3’端的相对稳定性。不过,最近一系列针对miRNA开展的深度测序研究结果显示,人体细胞可能刚好利用了这种剪切的不精确性,因为这样可以利用同一前体RNA分子获得大量不同的miRNA产物,从而大大扩展了miRNA分子的调控对象和途径。
2 RISC复合体的结合、装载过程
由dsRNA前体分子生成的miRNA在结合、装载到RISC复合体时会从双链状态解离成单链状态。这其中的关键步骤就是小dsRNA的解链过程和向导链被选择的过程。普遍认为,RISC装载过程实际上就是一个热力学问题。由于小dsRNA分子的热力学不对称(thermodynamic asymmetry)特性,是的其中一条链被选择,另一条链被“抛弃”、降解。也就是说,小dsRNA分子中哪一条链的5’端如果在热力学上显得更不稳定,那么他就是更有可能被RISC复合体“挑中”成为导向链,这也就是所谓的不对称原理(asymmetry rule)。
在人体细胞中,pre-miRNA会与AGO2蛋白、DICER1蛋白和TRBP蛋白组成的三聚体相结合。这个复合体可以利用pre-miRNA降解目的RNA,也能在缺乏ATP水解作用的情况下区分miRNA和miRNA*。这说明在这个三聚体当中,是DICER1蛋白来切割并感知RNA分子的热力学稳定性情况的。
这个RISC复合体聚合的过程也能以一种不依赖酶切作用的途径来完成。在人体细胞内,四种Argonaute蛋白中有三种(AGO1、AGO3、AGO4)都缺乏酶切活性,但它们仍然能够与向导链结合。尽管我们最开始认为的在未解链pre-miRNA双链分子中,由于存在错配情况,会遮蔽随从链的酶切位点,但我们仍在人体细胞内发现单链miRNA能够与AGO2蛋白相结合。因此,在人体细胞内肯定还存在一条不依赖酶切作用的旁路途径来帮助RISC复合体的组成。在这条旁路途径中,已发现RNA解旋酶A可能会参与其中,发挥RNA解链作用。
3 miRNA的分选过程
RISC复合体一旦组成,就会继续完成RNA沉默机制里后续的一系列反应,包括抑制mRNA翻译,维持基因组稳定性等等。RISC复合体的这些特异性功能都与Argonaute蛋白相结合的特殊蛋白有关。换句话说,那就是不同的RISC复合体可根据组成它的Argonaute蛋白来区分。
在黑腹果蝇中,pre-miRNA是有DCR-1蛋白生成的。其后就依其自身结构与AGO1或AGO2蛋白相结合。如果小dsRNA分子中又不配对序列存在、中部形成突出结构(多见于miRNA前体分子中),那么它就会与AGO1蛋白结合。如果小dsRNA之间配对情况良好,那么它就会与AGO2蛋白相结合。这是因为DCR-2-R2D2异源二聚体可以招募AGO2蛋白形成RISC复合体前体,这种复合体可以很好地结合配对良好的小dsRNA分子,但是不能与上述配对不佳的小dsRNA分子结合。
不过,虽然AGO1蛋白比较倾向于结合序列中部分有错配情况的小RNA分子,但是大部分没有错配情况的miRNA-miRNA*双链分子同样能够与含有AGO1蛋白的RISC复合体结合,这说明AGO1结合途径是有选择性的,它不会毫无保留地完全接受被AGO2蛋白“筛掉”的小RNA分子。