
广州市黄埔区学大道揽月路广州企业孵化器B座402
电话:020-85625352
手机:18102256923、18102253682
Email:servers@gzscbio.com
Fax:020-85625352
QQ:386244141
参与m6A RNA修饰和功能相关的蛋白
日期:2020-03-05 标签:m6A
m6A去甲基化酶的鉴定和甲基化转录组的高通量测序分析确证了m6A RNA表观遗传修饰作为一个动态调控过程,并重新启动了近几年来的研究。随着对m6A在RNA剪接,降解和翻译中的基础作用的日益了解,细胞遗传学的许多基本概念已经发生了革命性的变化。

目前的大量研究表明m6A修饰主要发生在细胞核中,而其功能发生在细胞质中,与这个概念相一致,m6A“作者”(METTL3,METTL14,WTAP)和“消除者”FTO、ALKBH5主要存在于细胞核中,对RNA进行甲基化修饰或者去甲基化;而大多数“阅读者”YTHDF1、YTHDF2存在于细胞质中,与m6A RNA的翻译、降解等功能相关。
1、m6A RNA的“作者”---腺苷甲基转移酶METTL3,METTL14,WTAP
m6A mRNA甲基化是由多组分甲基转移酶复合物催化的,最初被分离为来自HeLa核提取物的约200kDa和约800kDa的亚复合物,METTL3较早被鉴定为该复合物的S-腺苷-L-甲硫氨酸(SAM)结合组分,并且可以显示其自身的催化功能,METTL3在真核生物中高度保守。
目前已有证据证明METTL3在m6A修饰中具有重要作用:在HeLa细胞中敲减METTL3导致总m6A水平下降约30%,并且在HepG2细胞中相同的敲低实验可能通过激活p53介导的途径诱导细胞凋亡;敲低METTL3降低了来自小鼠胚胎干细胞Hela细胞和HepG2细胞mRNA中的m6A峰,METTL3 / 2小鼠交配产生的囊胚中METTL3的基因消除导致mRNA上m6A几乎完全耗尽,进一步强调了METTL3在m6A修饰中的关键作用。
METTL14是m6A甲基转移酶复合物的另一种活性成分,与METTL3形成稳定的杂合复合物,METTL14与METTL3紧密同源,纯化的METTL14也能特异性甲基化共有的GAC基序,而METTL14的敲低也可能导致mRNA中m6A含量的降低。
生物化学表征显示这两种蛋白质以1:1的化学计量比形成稳定的复合物。尽管METTL14的甲基化活性在体外略高于METTL3,但甲基转移酶的组合导致甲基化活性显着增强。这种异源二聚体还显示出对同源m6A共有序列的强烈偏好和对体外结构较少的RNA的适度偏好。更有研究表明,这两个组分在细胞中形成复合物的甲基化活性比分开的部分活性更高。
WTAP是体内m6A甲基转移酶复合物的第三个关键组分。WTAP最初被鉴定为与Wilms肿瘤1(WT1)蛋白结合的剪接因子,对于细胞周期和早期哺乳动物胚胎发育至关重要。WTAP在m6A甲基化中的重要作用首先在酵母和拟南芥中发现,分别研究其同源物Mum2和FIP37,发现它们与METTL3结合,是mRNA高效甲基化所必需的。
WTAP与METTL3和METTL14相互作用,并与METTL3-METTL14异二聚体在细胞核内共定位以参与m6A RNA甲基化,尽管WTAP单独在体外没有显示任何甲基转移酶活性,但敲除WTAP显著降低了细胞mRNA中的m6A峰,甚至比敲低METTL3或METTL14更显著。
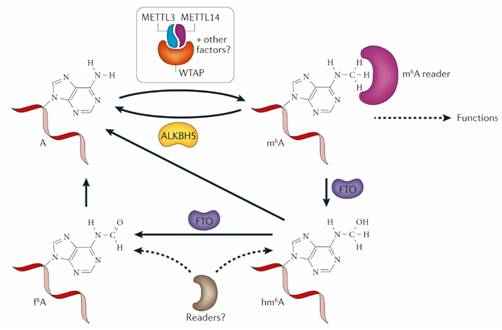
图2 甲基转移酶和去甲基化酶的对m6A RNA的作用
2、m6A RNA的“消除者”---去甲基化酶FTO和ALKBH5
FTO是ALKB家族的成员。FTO是发现的第一个RNA去甲基化酶,是m6A生物学研究的一个重要突破。Fto基因最初是在缺失导致突变小鼠融合表型的4个基因中发现的。FTO最初显示在单链DNA中N3-甲基胸腺嘧啶核苷和单链RNA中的N3-甲基尿苷在体外去甲基化;然而,体内FTO的功能仍然是未知的,直到发现FTO在体外m6A有效去甲基化RNA和DNA。
进一步的实验显示HeLa和293FT细胞中FTO的沉默增加了聚腺苷酸化RNA中的总m6A水平,并且FTO的过表达降低了RNA上的m6A水平。FTO失调与肥胖,脑畸形和生长迟缓的相关性,m6A可能在这些疾病中具有重要的调节功能。FTO作为m6A去甲基化酶的发现提示了m6A在人类发育调节中的功能作用,为了达到揭示潜在机制的最终目标,需要大量的未来工作来鉴定FTO的生理RNA靶标并阐明这种去甲基化的功能性后果。
ALKBH5是AlkB家族的另一种蛋白质,在mRNA和其他类型的核糖核酸中显示出对m6A的高效去甲基活性。与FTO不同的是,ALKBH5催化反应直接从m6A-甲基化腺苷上去除甲基,而不是氧化去甲基化。Alkbh5基因敲除的小鼠显示睾丸中凋亡细胞显著增加,表明精子发生缺陷。研究发现,除了mRNA之外,其他类型的核RNA也是ALBKH5的底物。
3、m6A RNA的“阅读者”---m6A特异结合蛋白YTHDF1-3、eIF3、HNRNPC和HNRNPA2B1
m6A RNA甲基化和去甲基化酶的发现表明m6A修饰是动态和可逆的,这与表观遗传DNA和组蛋白修饰相似。对于m6A组具有生物学功能,则需要通过特定蛋白质的识别来完成。
可以设想m6A在RNA上的三种选择性机制:首先,识别蛋白可以选择性地与含m6A的RNA结合;其次,特定序列中m6A的存在可能削弱RNA与结合蛋白相互作用;第三,m6A的存在可能改变RNA的二级结构,从而改变蛋白质-RNA相互作用。在哺乳动物细胞中,已经鉴定了三种宿主蛋白YTHDF1,2和3(YTHDF1-3)作为选择性m6A结合蛋白(“阅读者”)。
三种YTHDF蛋白都含有保守的羧基末端YTH结构域 结合m6A和功能不清的更可变的氨基末端效应子结构域。已有证据证实哺乳动物YTHDF蛋白优先结合于G [G> A] m6ACU共有序列处含有m6A的RNA。
用YTHDF1-3免疫沉淀的RNA中m6A的富集进一步支持YTHDF蛋白作为m6A特异性RNA结合蛋白的作用,RNA免疫沉淀和PAR-CLIP实验显示除了一些lncRNA靶标之外,大多数mRNA作为YTHDF2的靶标。许多研究表明m6A阅读器蛋白YTHDF2识别m6ARNA并介导甲基化RNAs的降解,而YTHDF1和3则与促进m6A的mRNA的翻译。
图3 YTHDC1介导m6A修饰的mRNA转移
真核起始因子3(eIF3)是43S翻译起始复合物的一个组成部分,最近报道eIF3与5’ UTR m6A直接结合。研究显示,eIF3结合位点主要定位于mRNA的5’UTRs,这对于调节翻译起始是重要的。YTHDF1被报道与eIF3相互作用,研究人员发现,eIF3与5’UTR m6A的结合与YTHDF1无关,从而支持eIF3能够直接结合m6A。
HNRNPC是已知参与mRNA前体加工的丰富的核内RNA结合蛋白,进一步的研究显示m6A对HNRNPC-RNA结合的调节影响靶转录物的丰度和选择性剪接。
HNRNPA家族的另一个成员HNRNPA2B1的结合位点中RGAC元件的高度富集,表明HNRNPA2B1是m6A阅读者候选者。进一步的研究表明,与背景缺失相比,HNRNPA2B1交联诱导的缺失与m6A峰重叠20倍,这支持HNRNPA2B1作为m6A阅读器直接结合m6A共有序列的子集。此外,HNRNPA2B1与作为pri-miRNA微处理器复合物的组分的DGCR8蛋白相互作用,并促进pri-miRNA的加工。
参考文献:
1、GuangchaoCao,Hua-Bing Li,Zhinan Yin,et al. Recent advances in dynamic m6A RNA modification.OpenBiol,2016,6:160003
2、BoxuanSimen Zhao,Xiao Wang,Alana V. Beadel,et al. m6A-dependent maternal mRNAclearance facilitates zebrafish maternal-to-zygotic transition.Nature, 2017,23;542(7642):475–478
3、YeFu,Dan Dominissini,Gideon Rechavi,et al. Gene expression regulation mediatedthrough reversible m6A RNA methylation. Nature Reviews Genetics,2014,10.1038/nrg3724
4、HaoDu,Ya Zhao,Jinqiu He, YTHDF2 destabilizes m6A-containing RNA through directrecruitment of the CCR4–NOT deadenylase complex.NAT COM,2015,10.1038/ncomms12626
5、ClaudioR. Alarco ´ n,Hani Goodarzi,Hyeseung Lee,et al. HNRNPA2B1 Is a Mediator ofm6A-Dependent Nuclear RNA Processing Events. Cell,2015,162,1–10
