The LINK-A lncRNA activates normoxic HIF1α signalling in triple-negative breast cancer
联系电话:020-85625352
Email:servers@gzscbio.com
转录因子相关调控研究案例(二)
一、调控通路
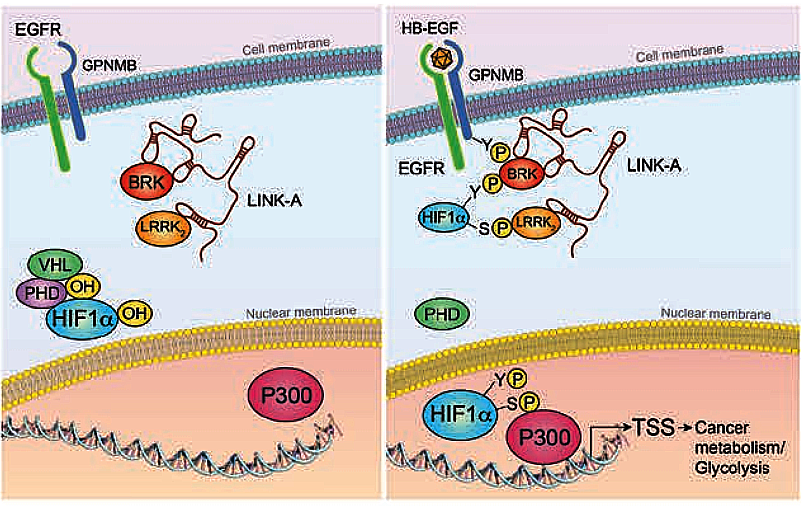
LncRNA LINK-A在细胞质中与蛋白BRK、LRRK2结合,当有胞外因子刺激时,LINK-A与蛋白复合物接收EGFR/GPNMB信号然后与转录因子HIF1结合,BRK将HIF1的Tyr 565磷酸化,LRRK2将HIF1的Ser 797磷酸化,HIF1磷酸化后进入细胞核与P300共同作用于癌相关基因的启动子促进基因转录表达。
二、实验流程
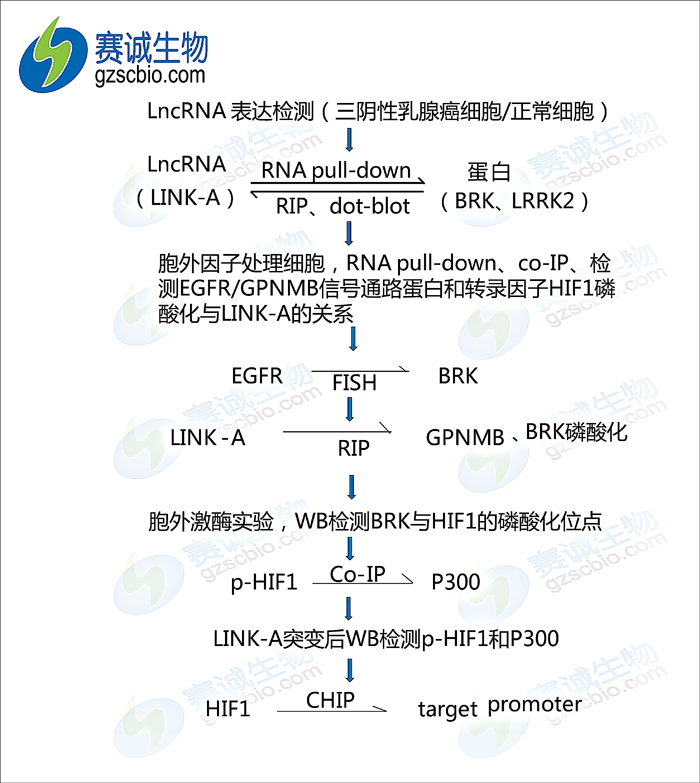
作者首先通过检测三阴乳腺癌细胞和正常细胞的LINK-A表达验证在三阴乳腺癌中LINK-A高表达确定本文的主角;为了验证LINK-A与蛋白BRK和LRRK2结合,作者分别进行RNA pull-down、RIP、dot-blot验证并找出了与这两种蛋白结合的RNA位点;EGFR/GPNMB信号通路的激活:作者分别用RNA pull-down、co-IP、纯化标签融合蛋白的co-IP等实验验证了胞外因子HB-EGF刺激信号通路使HIF1磷酸化;用FISH、RIP和胞外激酶实验验证HB-EGF刺激使细胞中EGFR/GPNMB与LINK-A、BRK/LRRK2互作;用体外激酶实验和各种WB实验检测HIF1的磷酸化位点;作者先用co-IP验证HIF1与P300的互作,再通过对LINK-A进行BRK、LRRK2结合位点的突变检测HIF1的磷酸化和P300的结合来说明磷酸化的HIF1与P300互作是通过LINK-A与BRK、LRRK2结合后介导的;最后作者通过CHIP实验验证磷酸化的HIF1结合到靶标基因启动子上促进基因的表达。
三、核心FIGURE:
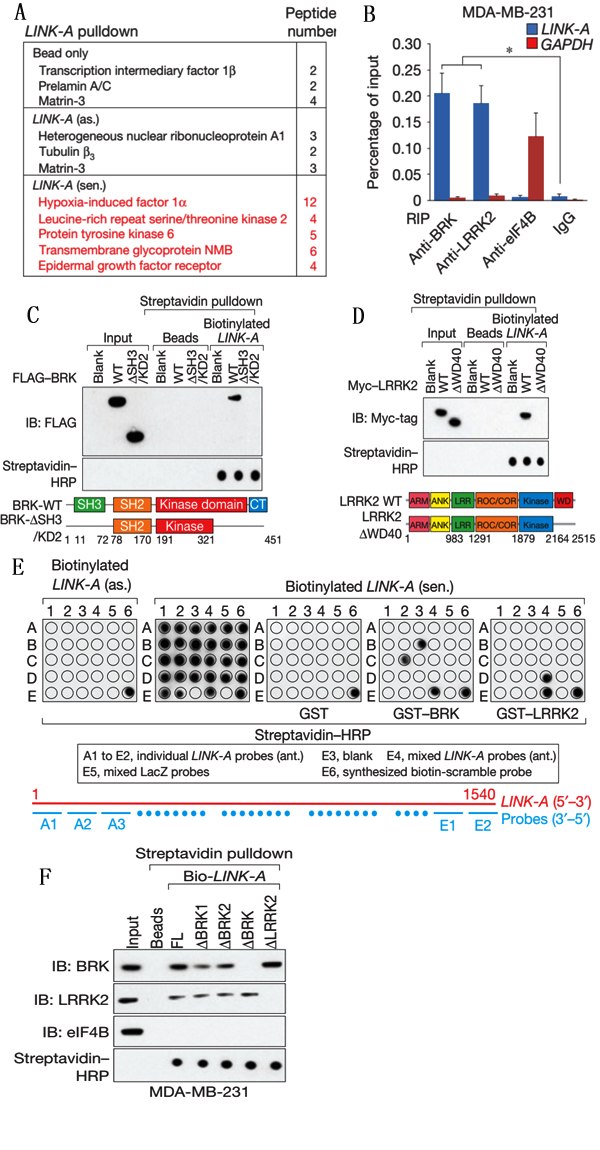
Figure1说明的是LINK-A与蛋白BRK和LRRK2结合,并找到的与蛋白结合的RNA位点。
A、RNA pull-down,用LncRNA Link-A探针钓取细胞内与之结合的蛋白,联用质谱分析。
B、RIP实验,用BRK和LRRK2蛋白抗体钓取与蛋白结合的RNA,然后进行Q-PCR检测验证Link-A与这两种蛋白高度结合。
C-D、RNA pull-down,用LINK-A探针分别与纯化的带FLAG标签融合蛋白BRK和带MYC标签的融合蛋白LRRK2孵育钓取结合蛋白,然后进行WB检测表明LINK-A直接与BRK以及LRRK2蛋白结合。
E、斑点印迹杂交,体外将生物素标记的LINK-A与标签融合蛋白结合然后进行斑点杂交检测LINK-A与蛋白的结合位点区段。
F、RNA pull-down,用LINK-A全长和去除斑点印迹法检测到的与蛋白结合位点的突变探针钓取蛋白,然后进行WB验证LINK-A与蛋白的结合区段。
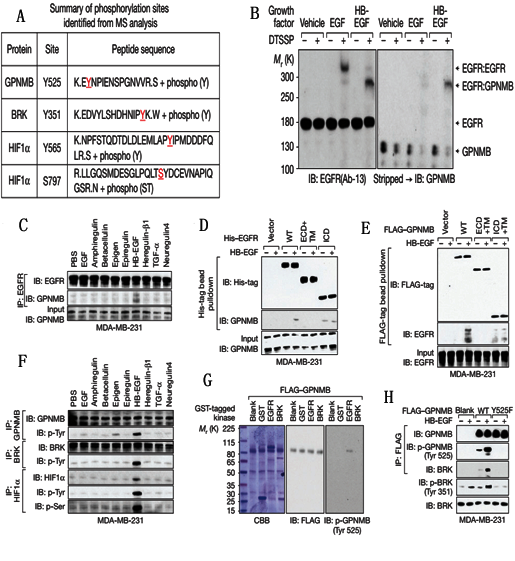
Figure2说明的是HB-EGF诱导LINK-A-蛋白复合体与信号通路蛋白EGFR/GPNMB结合,并促使HIF1磷酸化。
A、 RNA pull-down,细胞经HB-EGF诱导后,用LINK-A探针钓取RNA结合蛋白,然后进行质谱检测,表明HB-EGF刺激使LINK-A结合蛋白GPNMB、BRK、HIF1等。
B、WB,分别用EGFR和GPNMB抗体检测经生长因子处理后的细胞蛋白,结果表明HB-EGF处理后,EGFR与GPNMB结合。
C、Co-IP,用EGFR钓取经各种胞外因子处理后细胞中与之结合的蛋白,然后进行WB检测,表明经HB-EGF处理后,EGFR与GPNMB结合。
D-E、分别用纯化的带标签融合蛋白EGFR和GPNMB钓取经HB-EGF处理后细胞中的结合蛋白,然后进行WB验证表明EGFR与GPNMB直接结合。
F、Co-IP,分别用BRK、GPNMB和HIF1蛋白抗体钓取经胞外因子处理后细胞中的结合蛋白,然后用HIF1磷酸化抗体进行WB检测,结果表明HB-EGF诱导HIF1磷酸化。
G、体外激酶实验,表明GPNMB被磷酸化。
H、用纯化的GPNMB带钓取经HB-EGF处理后中与之结合的蛋白,然后进行WB检测,表明HB-EGF处理后BRK与GPNMB结合并被磷酸化。
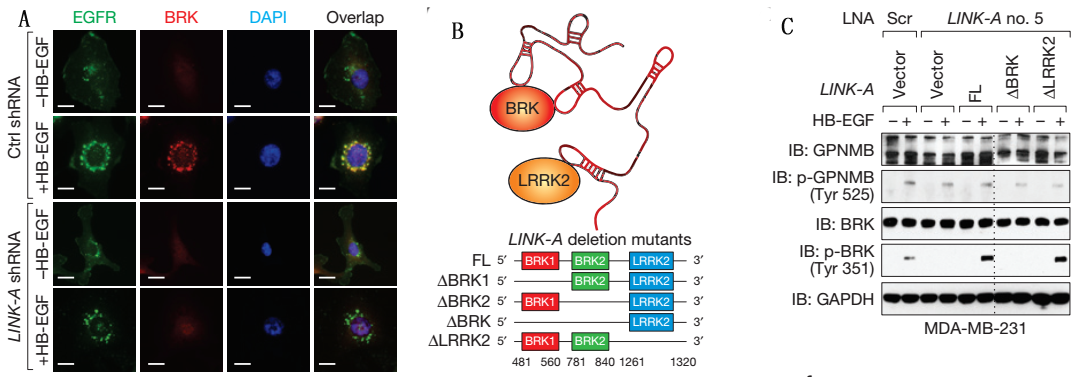
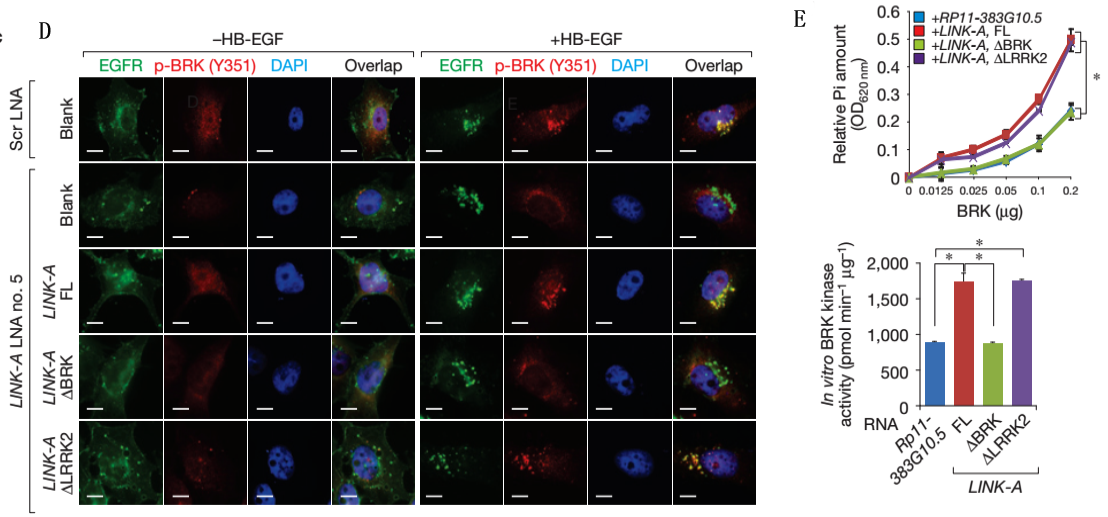
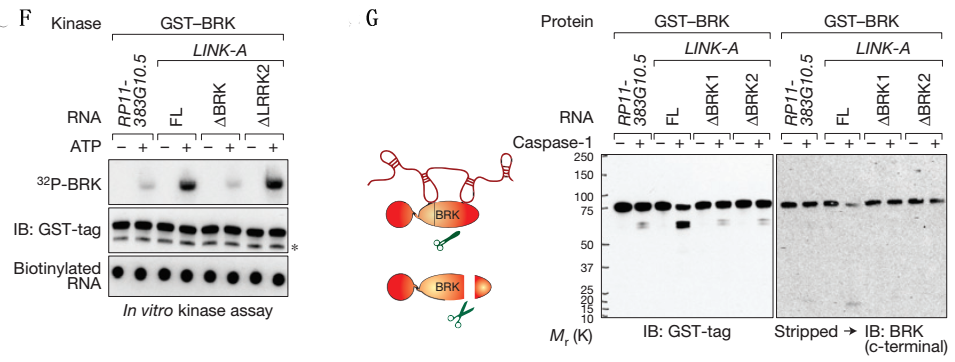
Figure3说明的是HB-EGF诱导细胞EGFR/GPNMB与BRK、LRRK2互作。
A、FISH,分别对LINK-A敲低细胞经HB-EGF处理后的细胞中EGFR和BRK进行定位,表明HB-EGF处理使这两种代表有互作。
B、LINK-A与蛋白BRF、LRRK2结合位点信息。
C、RIP,分别用LINK-A全长和去除蛋白结合位点的探针钓取细胞中与之结合的蛋白,然后用磷酸化的蛋白抗体进行WB验证,表明GPNMB和BRK磷酸化并验证了B图所示的结合位点。
D、FISH,表明HB-EGF处理后的细胞中EGFR和磷酸化的BRK互作。
E-F、体外激酶实验。
G、体外RNA-蛋白结合实验,用完整蛋白和去除部分组分的蛋白与LINK-A全长和去除蛋白结合位点的RNA进行结合实验。
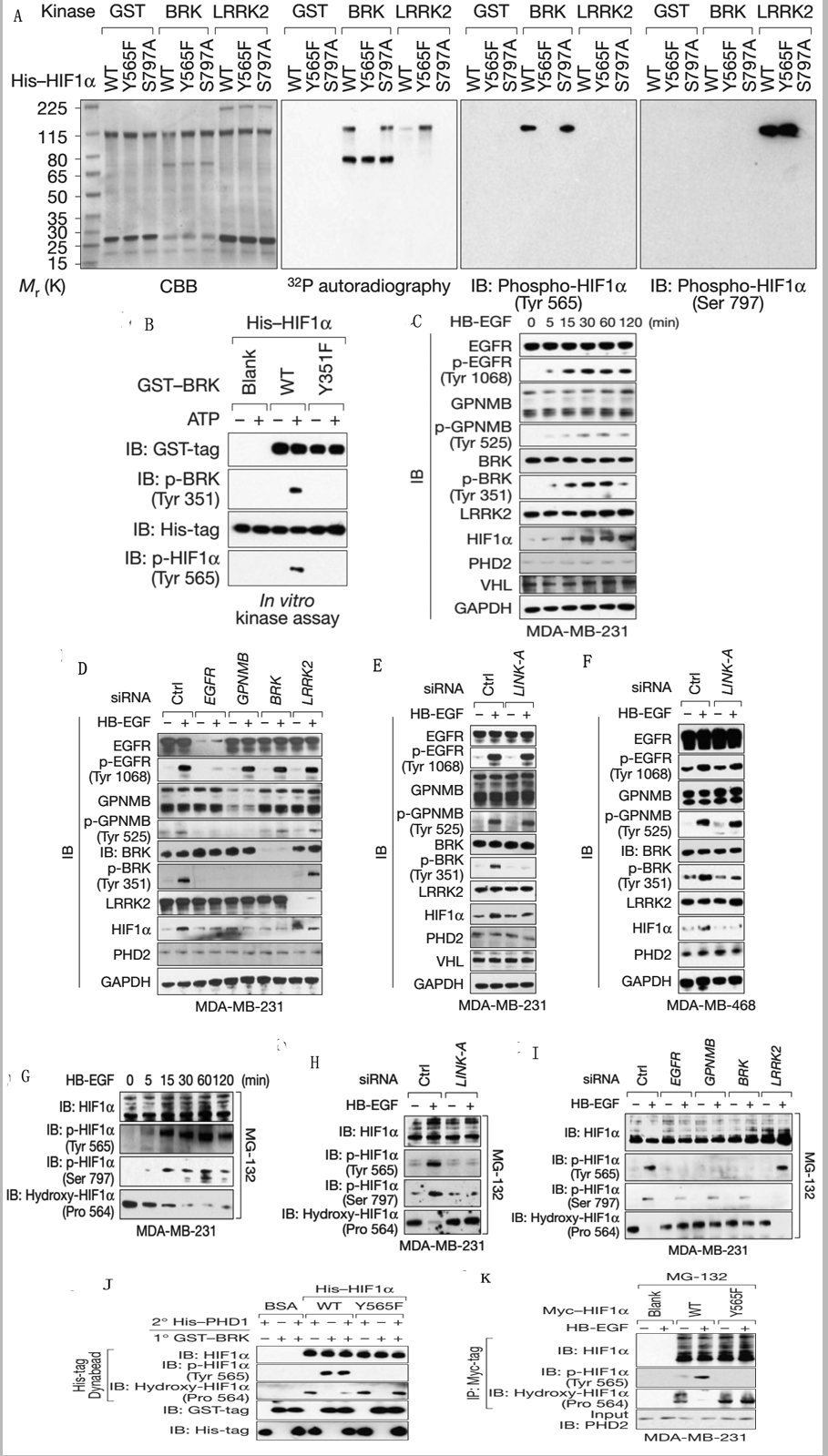
Figure4说明的是HB-EGF激活信号通路BRK促进HIF1 Tyr565位点磷酸化,HIF1 Tyr565的磷酸化使Pro564羟基化。
A、体外激酶实验,表明HIF1的磷酸化位点为Tyr565和Ser797。
B、体外激酶实验,BRK促进HIF1 Tyr565位点磷酸化。
C、WB检测HB-EGF诱导各种蛋白磷酸化情况。
D-F、LINK-A敲低后经HB-EGF诱导的各种蛋白磷酸化情况。
G、HB-EGF处理细胞不同时间后检测HIF1 Tyr565和Ser797位点的磷酸化Pro564羟基化。
H、LINK-A敲低后经HB-EGF诱导的HIF1 Tyr565和Ser797位点的磷酸化Pro564羟基化。
I、各种蛋白敲低后经HB-EGF诱导的HIF1 Tyr565和Ser797位点的磷酸化Pro564羟基化。

![]()
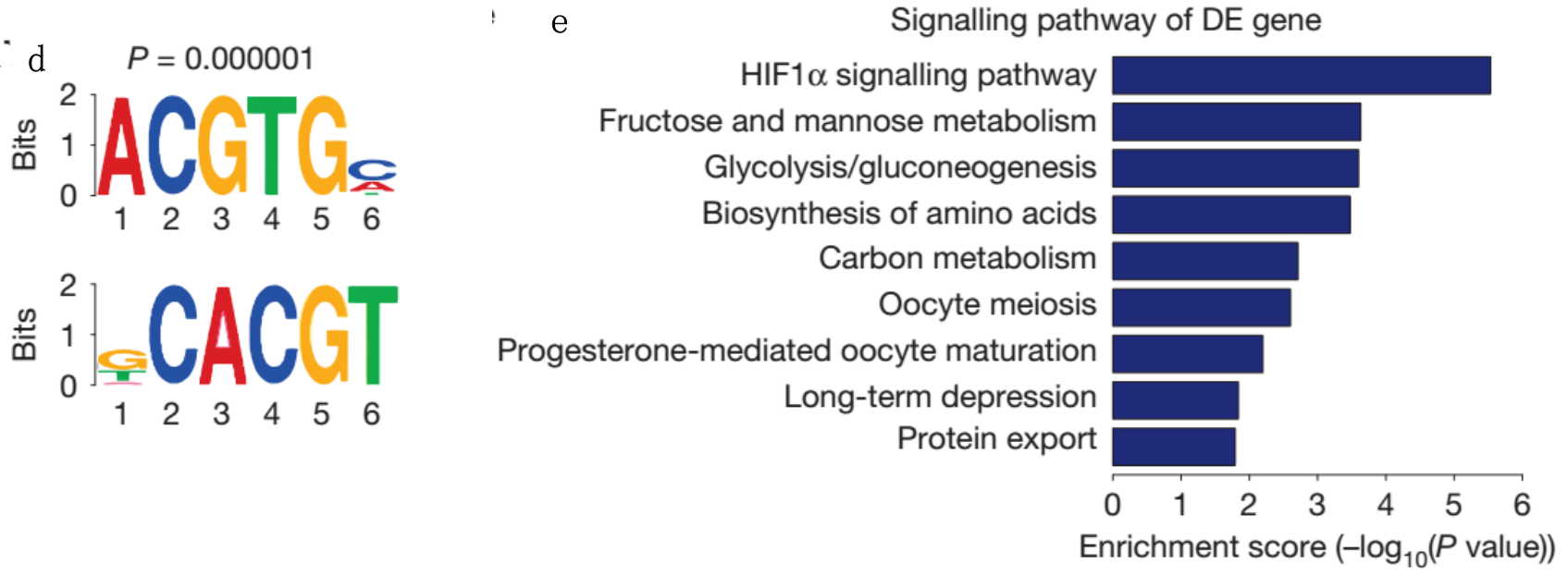
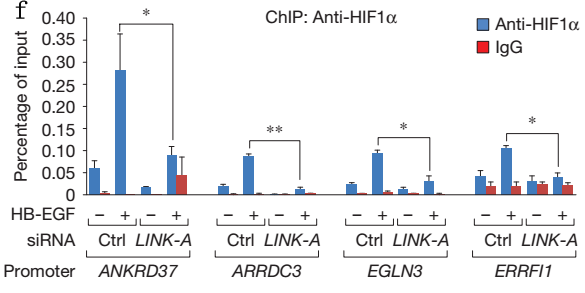
Figure5说明的是LINK-A促进HIF1磷酸化,磷酸化的转录因子HIF1与P300互作促进靶标基因的转录。
A、co-IP,用HIF1抗体钓取LINK-A和LRRK2敲低后经HB-EGF诱导细胞中的结合蛋白,然后用WB验证,表明磷酸化的HIF1与P300结合。
B、co-IP,用纯化的带标签融合HIF1和Ser797位点突变的HIF1与细胞总蛋白孵育,然后用标签抗体钓取结合蛋白进行WB验证,表明Ser797位点突变的HIF1不能与P300结合。
C、将LINK-A全长和BRK、LRRK2结合位点突变的表达载体导入细胞,然后检测经HB-EGF诱导后的磷酸化的HIF1,表明LINK-A的BRK、LRRK2结合位点突变后,HIF1不能磷酸化。
D-E、CHIP-seq,HIF1抗体钓取HB-EGF处理后的细胞中与之结合的DNA片段,然后进行高通量测序,C为HIF1结合的DNA富集motif,D为结合的靶标。
F、CHIP-q-pcr,HIF1抗体钓取HB-EGF处理后的细胞中与之结合的DNA片段然后进行Q-PCR验证,表明HB-EGF促进HIF1与靶标基因启动子结合。
本公司可提供的技术服务项目
本公司可进行类似实验的实验设计及整体实验外包项目,包括RNA pull-down、RIP、WB、慢病毒稳转株的建立(过表达/敲低)、Q-PCR、FISH、CHIP,其中RNA pull-down、FISH、RIP、CHIP为本公司主营项目。
一、RNA pull-down:检测RNA结合蛋白与其靶RNA之间相互作用的主要实验手段之一。
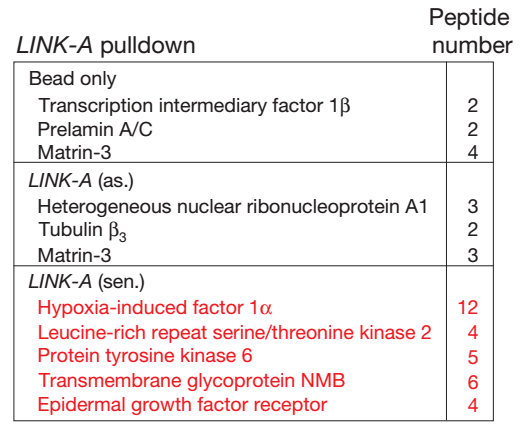
本实验作者用LINK-A探针钓取经HB-EGF处理后的细胞裂解液中与之结合的蛋白,pull-down产物进行质谱检测分析,筛选出HB-EGF诱导结合的蛋白。我公司在实验体系中同时提供lncRNA正义链与反义链的pull down。
二、 RIP:主要研究蛋白与RNA的相互作用
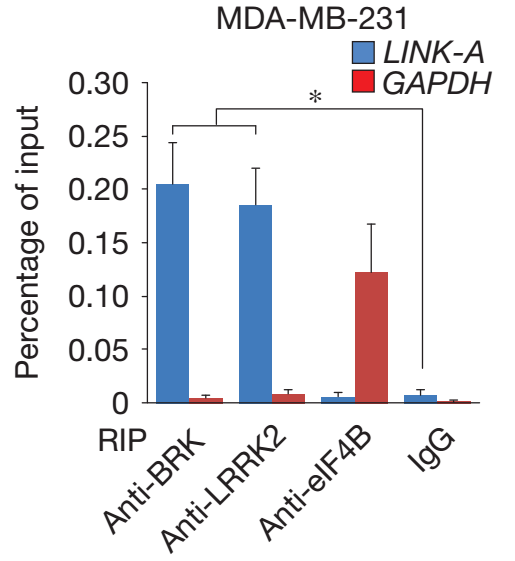
分别用BRK和LRRK2蛋白抗体钓取细胞中与蛋白结合的RNA,然后进行Q-PCR检测,结果表明LINK-A与蛋白BRK和LRRK2结合。我公司在实验体系中设置阳性及阴性对照,进一步排除系统误差。
三、Co-IP:检测蛋白与蛋白的互作。
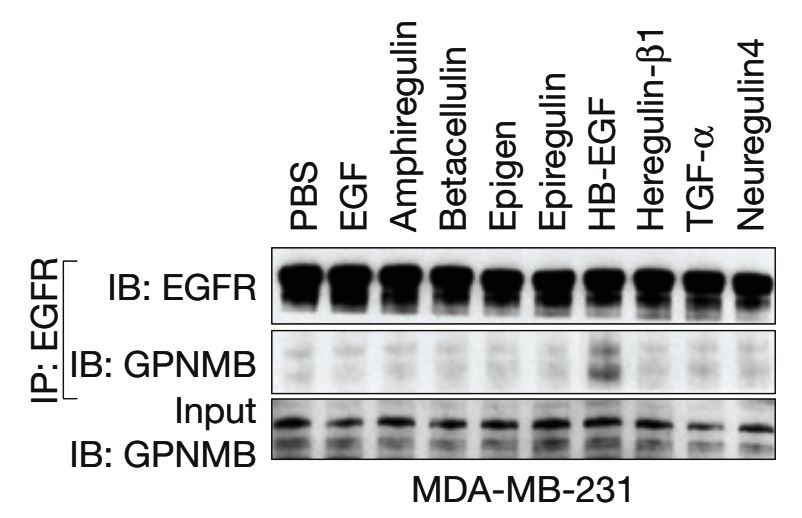
用EGFR蛋白抗体钓取经不同胞外因子处理后细胞中与EGFR结合的蛋白,产物进行WB验证,结果表明HB-EGF促进EGFR与GPNMB结合。
三、FISH:免疫荧光原位杂交,对细胞内核酸和蛋白的定位。
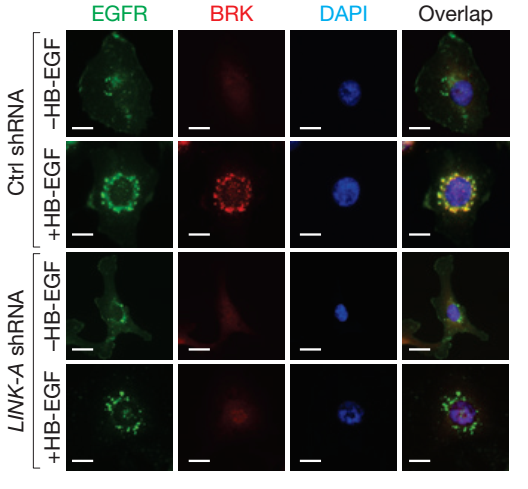
作者用免疫荧光原位杂交对细胞内的蛋白EGFR和BRK进行定位,结果表明经HB-EGF处理后细胞内EGFR与BRK互作。我公司在实验体系中设置阴性和阳性对照。
四、CHIP:主要研究蛋白与基因启动子之间的关系

用HIF1抗体钓取LINK-A敲低细胞经HB-EGF处理后与HIF1结合的DNA片段,产物进行Q-PCR检测,结果表明LINK-A敲低后HIF1结合靶标基因启动子下降,说明LINK-A在转录因子结合基因启动子的重要作用。
参考文献:Aifu Lin1,Chunlai Li1, Zhen Xing,et al. The LINK-A lncRNA activates normoxic HIF1α signalling in triple-negative breast cancer[J]. NATURE CELL BIOLOGY,2016, 10.1038/ncb3295