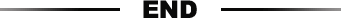广州市黄埔区学大道揽月路广州企业孵化器B座402
电话:020-85625352
手机:18102256923、18102253682
Email:servers@gzscbio.com
Fax:020-85625352
QQ:386244141
dcas9技术应用案例之一: 稳定的 dCas9 激活剂用于控制人类细胞重编程和分化中的基因表达 激活剂用于控制人类细胞重编程和分化中的基因表达
日期:2020-03-04 标签:dcas9

CRISPR Cas9是最近几年兴起用于靶向基因特定DNA修饰的重要工具。抑制或,可以将与反式激活域融合的CRISPR / Cas9蛋白用于控制人类细胞中的基因表达。在本研究中,作者证明了带有VP16激活子域的dCas6融合蛋白可以有效激活涉及多种细胞类型的多能性的人类基因。该激活剂与靶向OCT4启动子的sgRNA结合可以完全替代人类细胞重编程中的转基因OCT4。此外,通过与二氢叶酸还原酶(DHFR)稳定域的融合生成了化学控制的dCas9激活剂版本。最后,作者证明了稳定的cas9激活剂可用于控制人多能干细胞向内胚层的分化。
1、dCas9-反式激活因子dCas9VP192多能性基因转录激活
迄今为止,大多数研究都使用了dCas9激活物,其VP16反式激活序列重复了多次,为了测试增加 VP16 重复结构域数量的效果,作者克隆了带有 VP16 序列的 6 和 12 个重复序列的其他构建体(图1A)。并在HEK293细胞中将五个gRNA定位于内源OCT4(POU5F1)启动子区域,在mRNA和蛋白水平均检测到有效的OCT4上调(图1B和1C)。由于dCas9VP192导致OCT4表达水平的最高增加,最高达到70倍,因此将其用于进一步的实验。通过单个 gRNA 转录单位与dCas9VP192质粒一起转染。转染72小时后,可通过免疫细胞化学(图1E和1F)qRT-PCR 分析(图1G)检测目标内源性因子的表达,显示内源性靶向基因被激活。与基础水平相比,OCT4,SOX2,NANOG 和 CDH1 转录上调了 20 倍以上。
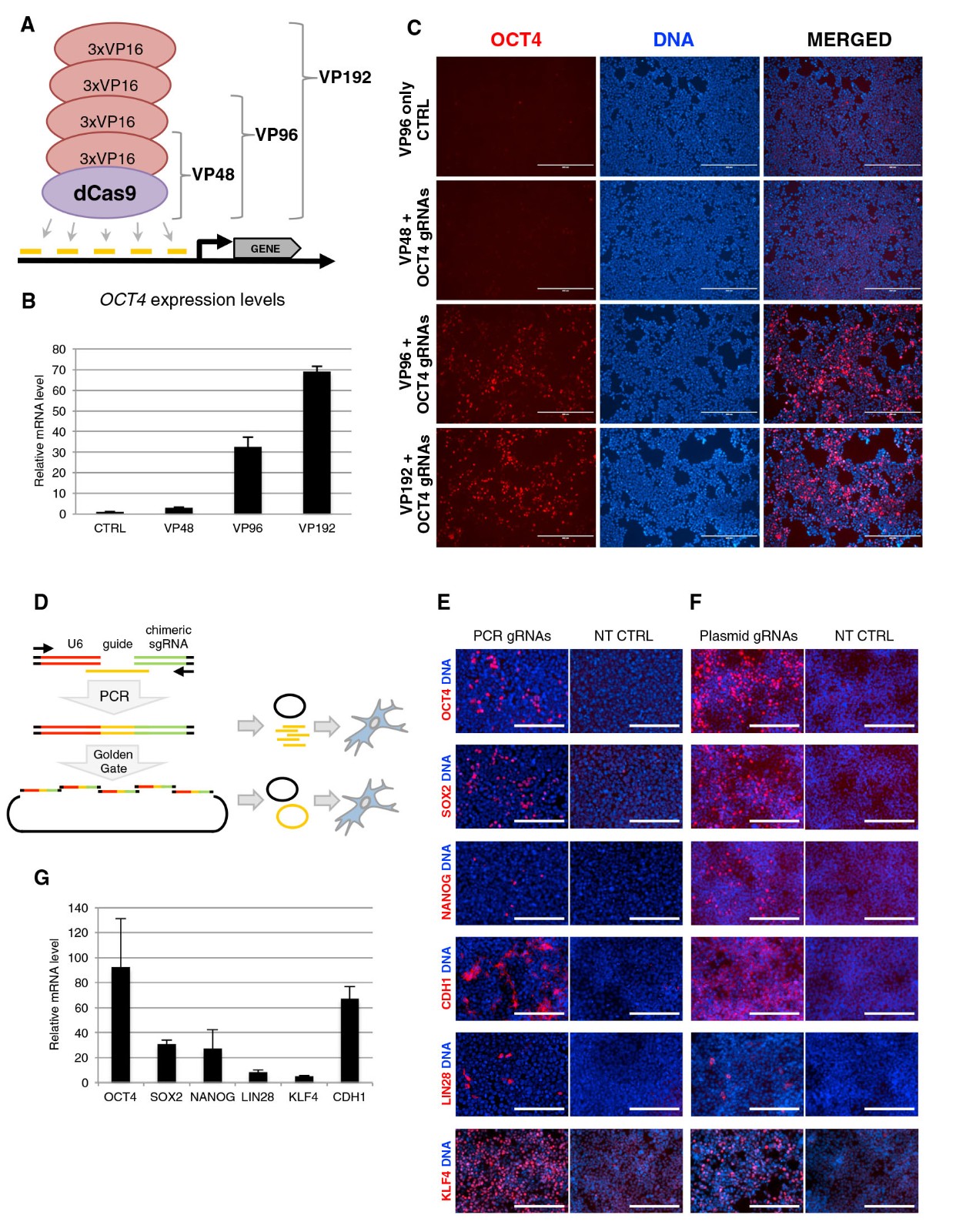
图 1. dCas9 介导的多能性基因激活策略
(A) dCas9 激活版本的示意图。
(B) 通过不同的 dCas9 激活剂,HEK293 细胞中的 OCT4 上调。转染 72 小时后,通过 qRT-PCR 测量相对 mRNA 表达水平。 VP96 转染用作对照。
(C) dCas9 激活剂和 OCT4 靶向 gRNA 转染后 72 小时,HEK293 细胞中 OCT4 的免疫细胞化学分析。
(D) gRNA 克隆和测试策略的示意图。首先用 PCR 扩增的片段验证 gRNA,然后通过 Golden Gate 组装将它们连接成质粒。
(E) PCR gRNA 片段和 dCas9VP192 质粒转染后 72 小时,HEK293 细胞中靶基因产物的免疫细胞化学检测。未处理的(NT)HEK293 细胞用作染色对照。
(F) 在用 gRNA 连接的质粒和 dCas9VP192 质粒转染的 HEK293 细胞中激活靶向基。
(G)用 gRNA 级联的质粒和 dCas9VP192 质粒转染后 72 小时,通过 qRT-PCR 在 HEK293 细胞中测量了靶向基因的 mRNA 水平。
2、重编程因子 OCT4 被 dCas9VP192 介导的基因激活取代
为了研究编码gRNA的质粒和dCas9VP192激活人类皮肤成纤维细胞中基因表达的能力,作者将dCas9VP192激活剂和连接的克隆克隆到瞬时复制的含OriPEBNA1的质粒中。通过免疫细胞化学检测电穿孔后第6天细胞中检测到内源性OCT4,SOX2和LIN28A的激活,而通过qRT-PCR检测到OCT4和SOX2的激活(图2A–2C)。先前已经证明,通过靶向Oct4远端增强子,可以在小鼠成纤维细胞重编程中使用包含4至10个VP16重复序列的dCas9激活剂来替代转基因Oct4。为了确定dCas9VP192介导的OCT4激活在人类细胞重编程中是否起作用,用dCas9VP192和OCT4启动子靶向指南替代了附加型重编程方案中的转基因OCT4质粒(图2D)。第6天,可以在表达p53显性负型的电穿孔人皮肤成纤维细胞中检测到内源性OCT4的激活(图2E)。在第18天检测到重编程第9天形成的早期菌落和经典碱性磷酸酶阳性(AP +)iPSC菌落(图2F)。 OCT4指导质粒已被GFP编码质粒替代的对照条件未导致AP +集落形成或内源性OCT4活化(图2E)。为了比较dCas9VP192介导的内源OCT4激活与转基因OCT4表达的重编程效率,用重编程构建体对成年人皮肤成纤维细胞进行了电穿孔,并通过菌落形态和AP阳性评估了重编程效率。两种方法之间的菌落形成效率未发现显着差异(用于OCT4活化的板细胞为0.0054%,对于转基因OCT4为0.0021%)(图2G)。所有iPSC菌落均表达OCT4,NANOG,TRA-1-60和TRA-1-81(图2H), iPSC品系能够在胚状体中分化为FOXA2(内胚层),VIMENTIN(中胚层)和bIII-TUBULIN(外胚层)阳性的三种种系衍生物(图2I)。因此,可以通过用dCas9激活剂介导的内源OCT4激活代替OCT4过表达,将人皮肤成纤维细胞重编程为iPSC。
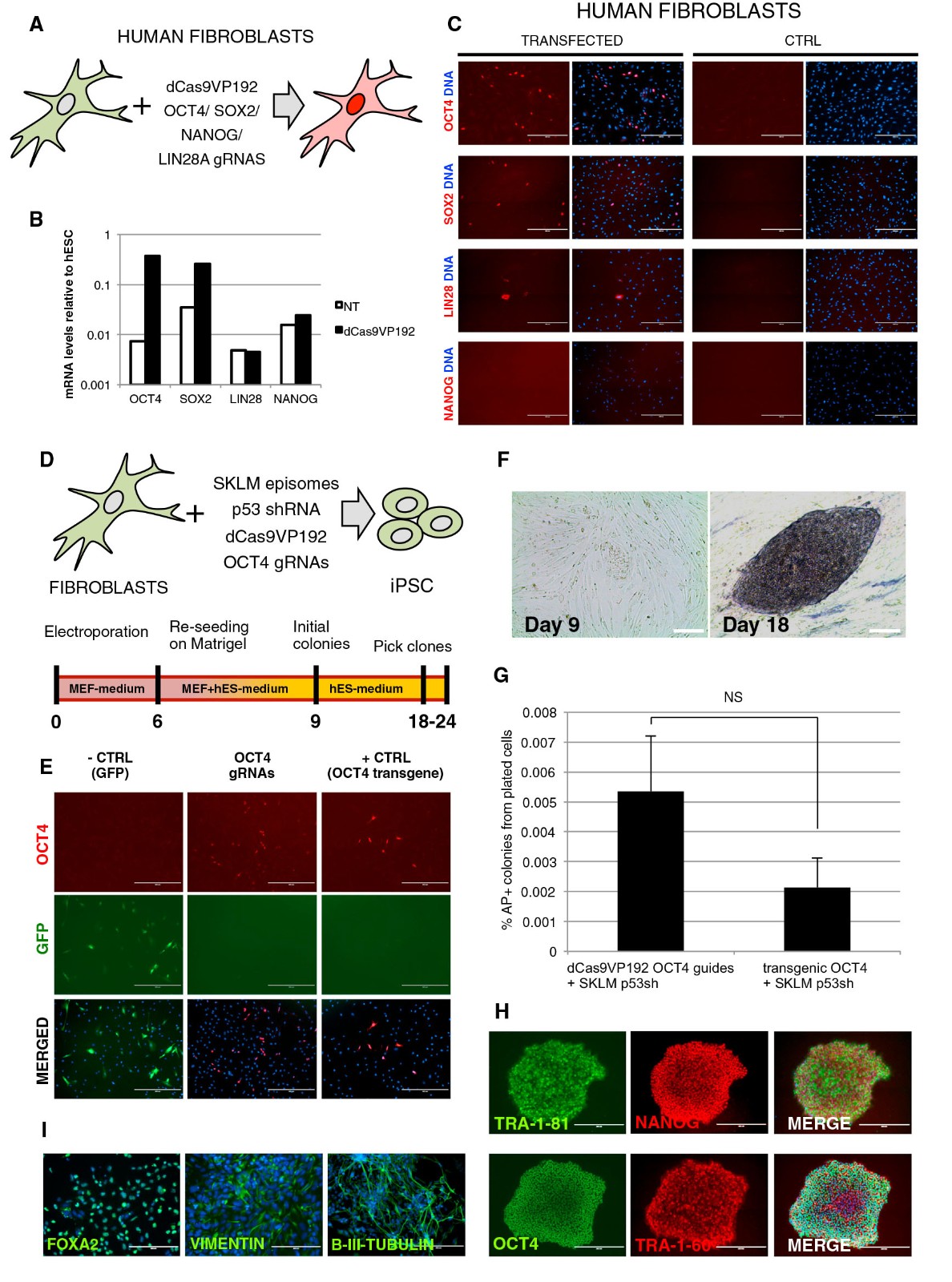
图 2. dCas9 激活剂在重编程为多能性中的功能验证
(A) dCasVP192 在瞬时电穿孔中靶向人类皮肤成纤维细胞因子的示意图。
(B 和 C)用 dCas9VP192-EBNA 和编码 gRNA 的 EBNA 对人皮肤成纤维细胞进行电穿孔后 6 天,进行 qRT-PCR 和靶向多能性因子的免疫细胞化学检测。
(D)OCT4 替换重编程协议中使用因素的示意图。
(E) 在重编程的第 6 天,免疫细胞化学检测人皮肤成纤维细胞中内源 OCT4 的激活。用 pCXLE-GFP(-CTRL),游离 SOX2,KLF4,LIN28 和 L-MYC 加 dCas9VP192 和 OCT4 gRNA 质粒或 pCXLE-OCT4(+ CTRL)电穿孔细胞。
(F) 用 dCas9VP192 替代转基因 OCT4 形成 AP +菌落。
(G)使用 dCas9VP192 和 OCT4 靶向指南或转基因 OCT4 与转基因 SOX2,KLF4,LIN28,L-MYC 和 p53 shRNA 进行的成人皮肤成纤维细胞的游离重编程效率比较。
(H) 免疫细胞化学检测多能性标记 TRA-1-81,NANOG,OCT4 和 TRA-1-60 在来源于正常人成纤维细胞的第 2 代 iPSC 中,用 dCas9VP192 和SKLM 转基因替代了转基因 OCT4。
(I) 使用 dCas9VP192.FOXA2(内胚层),VIMENTIN(中胚层)和 bIII-TUBULIN(外胚层)通过转基因 OCT4 置换,免疫组化检测PNDM 人成纤维细胞衍生的 iPSC 平板状胚状体中不同细菌层的标记。
3、条件稳定的 dCas9 激活剂
为了暂时控制dCas9激活剂的活性,作者将蛋白质N末端与大肠杆菌衍生的DHFR DD融合,这能够以TMP依赖性的方式控制活化剂的稳定性(图3A)。为了将TMP诱导的dCas9系统与更常用的强力霉素诱导的TetON系统进行比较,作者用TetONdCas9VP192,组成型DDdCas9VP192以及TetONDDdCas9VP192分别构建了稳定的HEK293细胞系,并以OCT4启动子为靶向。 结果表明TetON-dCas9VP192和DDdCas9VP192的性能相当(图3B和3C),在未诱导的d0样品中表现出渗漏表达,在加入强力霉素或TMP后,OCT4上调至人类胚胎干表达水平的5.2和6.6倍相应的细胞(hESC)。 TetON启动子和DHFR DD与dCas9VP192的结合消除了在没有强力霉素或TMP的情况下OCT4的非特异性激活(图3B和3C)。然后,构建了组成性表达DDdCas9VP192激活剂的HEK293细胞,并同时靶向OCT4,SOX2,NANOG和LIN28A启动子。在未经TMP处理的细胞中,可以检测到OCT4和SOX2的一些激活,而NANOG或LIN28A却未检测到(图3D)。添加TMP后,OCT4,SOX2和NANOG的表达在第1天就已经增加,分别达到在hESC(H9)中测得的表达水平的24%,187%和41%,与其他因素相反,未检测到LIN28A上调(图3D)。与强烈激活的OCT4不同,通过免疫细胞化学只能在少数细胞中检测到LIN28A表达(图3E)。为了测试人类原代细胞中的激活剂,构建了组成性表达DDdCas9VP192F72人皮肤成纤维细胞以OCT4,SOX2,NANOG和LIN28A启动子为靶向。 在不存在TMP的情况下,在成纤维细胞中未检测到泄漏激活(d0,图3F和3G)。 在存在TMP的情况下,到9天结束时,OCT4,SOX2和NANOG的表达逐渐升高,分别达到hESC水平的最高表达水平,分别为46%,63%和7%,但LIN28A上调(图3F)。 并且通过免疫细胞化学检测到稀有阳性细胞(图3G)。
图 3.通过条件稳定的 dCas9VP192 进行基因激活
(A) DDdCas9VP192 稳定性的示意图。TMP,甲氧苄氨嘧啶。
(B) 在表达或不存在 TMP 和强力霉素的情况下,在表达 DDdCas9VP192-T2A-GFP,TetON-dCas9VP192-T2A-GFP 或 TetON-DDdCas9VP192-T2A GFP 活化剂和 OCT4 靶向性的选定 HEK293 细胞中进行 OCT4 活化的免疫细胞化学染色。
(C)诱导型 DDdCas9,TetON-dCas9 和TetON-DDdCas9 激活剂在 HEK293 细胞中 OCT4 水平上调中的比较。用 1 mM TMP(对于DDdCas9),1 mg / ml 强力霉素(对于 TetON-dCas9)或两者(对于 TetON-DDdCas9)处理细胞长达 5 天。
(D 和 E)qRT-PCR 分析 1 mM TMP 诱导的 OCT4,SOX2 NANOG 和 LIN28A 的时间激活表达 DDdCas9VP192 的 HEK293 细胞和靶向这些基因的 gRNA 的免疫细胞化学。
(F 和 G)qRT-PCR 和免疫细胞化学分析 1 mM TMP 诱导的 OCT4,SOX2 NANOG 和 LIN28A 的时间活化表达 DDdCas9VP192 的人皮肤原代成纤维细胞(F72)和靶向这些基因的 gRNA。
4、dCas9VP192激活内胚层和胰腺转录因子
为了检查该方法在激活不同基因上的多功能性,作者使用dCas9VP192靶向一组内胚层和胰腺主转录因子。我们设计了靶向FOXA2,SOX17,GATA4,PDX1和NKX6.1的近端启动子的gRNA,结果分析表明,受试基因在蛋白质和mRNA水平上有明显的激活(图S4A)。据报道,使用dCas9激活剂激活内胚层转录因子SOX17可在hESC中有效工作,为了解决多能干细胞中dCas9VP192是否可以上调基因集,将dCas9VP192加上gRNA编码质粒转染到人iPSC。通过免疫细胞化学检测了所有五个测试基因的激活,,表明dCas9VP192也可以驱动多分化细胞中分化相关转录因子的表达(图4A,4B)。接下来,构建一个以结构性表达DDdCas9VP192激活剂的hESC系(H9)和靶向内胚层转录因子FOXA2和SOX17以及胰腺因子PDX1和NKX6.1的gRNA来测试该系统在定向分化中的适用性,在包括激活素A(AA)的完全培养基(TMP + AA条件)中,不使用激活素A的条件下,将H9-DDdCas9VP192细胞处理3天。对照(TMP AA),或含1 mM TMP且无激活素A(+ TMP AA)(图4C)。如所预期的,用AA处理3天的细胞分化为FOXA2 + / SOX17 +定形内胚层,但是不表达胰腺祖细胞标记基因(图4D)。相反,在同一时间段内添加TMP后,内胚层和胰腺转录因子的激活同时上调了胰腺祖细胞标记。这些细胞表达了直接由DDdCas9VP192激活的FOXA2,SOX17,PDX1和NKX6.1(图4D,4E)。重要的是,它们的下游靶转录因子SOX9和NKX2.2也在mRNA和蛋白质水平上都被诱导(图4D和4E)。
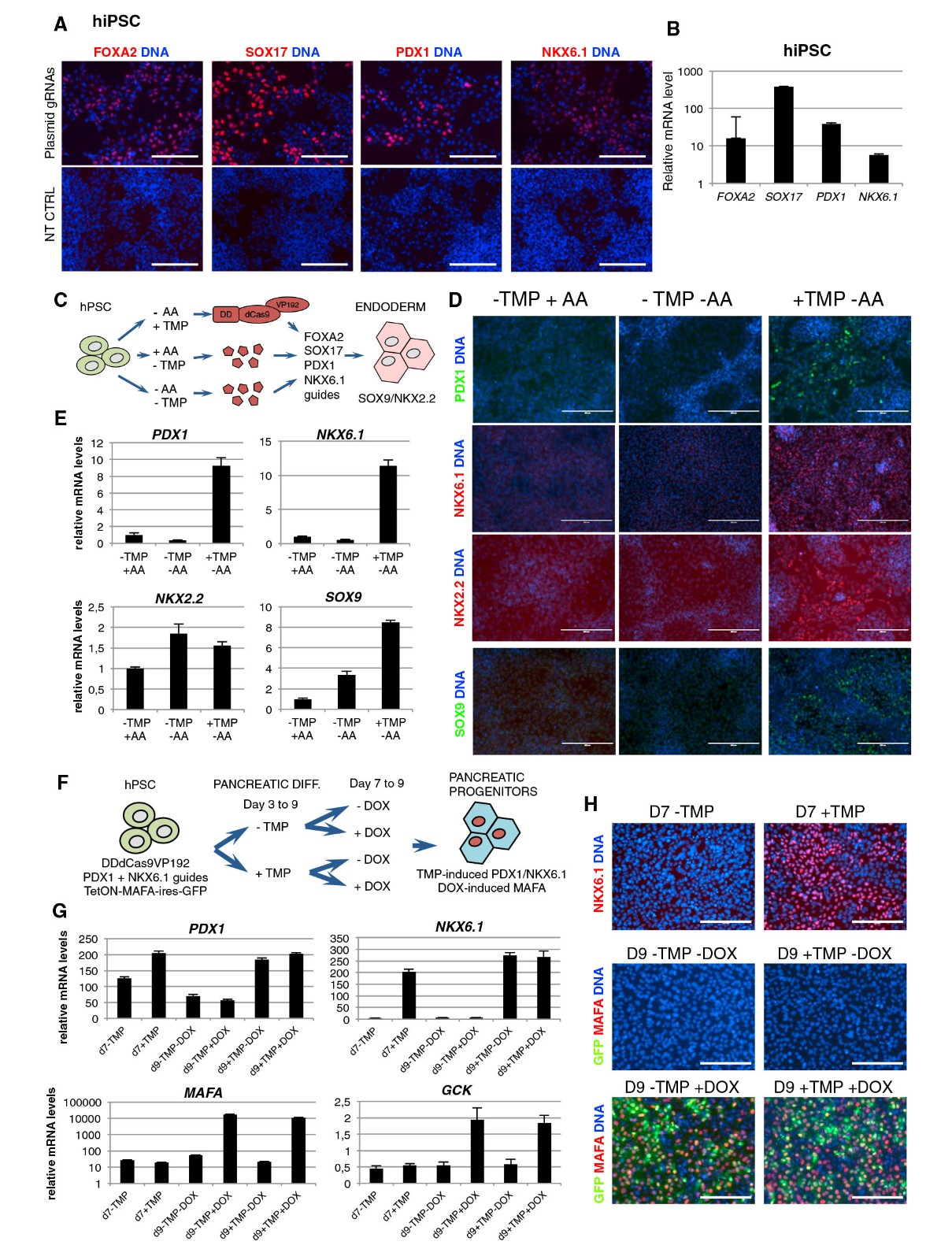
图4.dCas9VP192激活特定转录因子
(A)免疫细胞化学检测dCas9VP192靶向皮内和胰腺基因激活。
(B)qRT-PCR分析hiPSC中指示的靶向基因。对(A)和(B)的分析是 在GRNA级联质粒和dCas9VP192的传递后进行72小时的检测。
(C)DDdCas9VP192介导的皮内和胰腺基因激活分化hiPSC的原理图。
(D)表达DDdCas9VP192和gRNA的hESCH9的免疫细胞化学对于FOXA2、SOX17、PDX1和NKX6.1,在第3天分化为明确的内胚层。 胰腺组细胞标记物PDX1、NKX6.1(均为DDCas9VP192所针对)及其下游靶点NKX2.2和SOX9的染色。
(E)细胞trea的qRT-PCR分析。用两种方法对胰腺组细胞进行hPSC分化的原理图 不同时间点的诱导系统:TMP诱导DDdCas9VP192激活PDX1和NKX6.1内源性表达(第3至9天)和DOX诱导的Teton-MAFA-ires-GFP过表达系统(第9天) 7至9)。
(E)(F)所述实验的qRT-P CR分析。在/TMP处理的样本中,PDX1和NKX6.1的表达水平显示在第7天和第9天..MAFA及其下游目标GCK表达水平 在第7天和第9天显示在/DOX处理的样品中。数据代表平均±SEM,n=3个独立处理的样品。(H)HESC的NKX6.1和MAFA的免疫细胞化学。