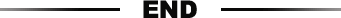广州市黄埔区学大道揽月路广州企业孵化器B座402
电话:020-85625352
手机:18102256923、18102253682
Email:servers@gzscbio.com
Fax:020-85625352
QQ:386244141
dCas9技术应用案例之二: dCas9 介导的转录微扰对肿瘤表型的多功能体内调节
日期:2020-03-04 标签:dCas9

靶向转录调控是研究细胞行为遗传介质的有力工具。靶向转录起始位点上游或下游的基因组区域的无催化功能得Cas9(dCas9)在体外和同基因免疫功能小鼠模型中的肿瘤细胞中进行特定且可持续的基因表达水平改变。作者使用这种方法在体内进行高覆盖基因激活筛选,并发现了肿瘤生长和治疗反应的先前未知的调节剂。而且,通过使用与激活结构域连接的dCas9,可以简单地通过改变相对于转录起始位点的dcas9结合位置来增强或抑制靶基因的表达,并且证明这些基因转录水平的定向的变化发生最小的脱靶效应。研究结果突出显示了使用dCas9介导的转录调控作为在体内可再现地查询肿瘤表型的通用工具
01
dCas9 对 Trp53 转录的抑制导致细胞对 DNA损伤的抵抗
CRISPR干扰(CRISPRi)可以通过直接干扰转录起始(靶向启动子)或阻断RNA延长(如果靶向特定基因的第一个外显子)来抑制转录。为了探索这种遗传失活是否足以模拟癌症进展和治疗耐药性演变过程中发生的遗传变化,用病毒载体的dCas9和特定sgRNA慢病毒共感染小鼠Eμ-Mycp19Arf-/-淋巴瘤细胞(图1 A和B)。作者筛选了多个靶向Trp53转录起始位点(TSS)周围基因组区域的sgRNA(图1C),目的是使用dCas9作为阻止转录延伸的“路障”(图1D)。在一半以上的散发性癌症中,TRP53发生了突变引起一系列广泛的细胞反应,TRP53的失活会加速癌基因介导的肿瘤发生,并使细胞对凋亡的敏感性降低。因此,作者首先研究了哪种sgRNA最能介导对DNA损伤的抗性。大多数sgRNA靶向外显子1,其他几个靶向上游和下游作为阴性对照。然后用DNA损伤剂顺铂处理这些表达和不表达sgRNA-dCas9的混合群体,并通过流式细胞仪测定表达sgRNA-dCas9与不表达细胞的相对组成(图1E)。发现,所有将dCas9靶向Trp53外显子1的sgRNA都能提高细胞对DNA损伤的抵抗力(图1F)。此外,发现dCas9介导的失活对TRP53激活其下游靶基因的能力具有深远影响,并且在大多数情况下,其影响要大于TRP53 shRNA(图1 G和H)。
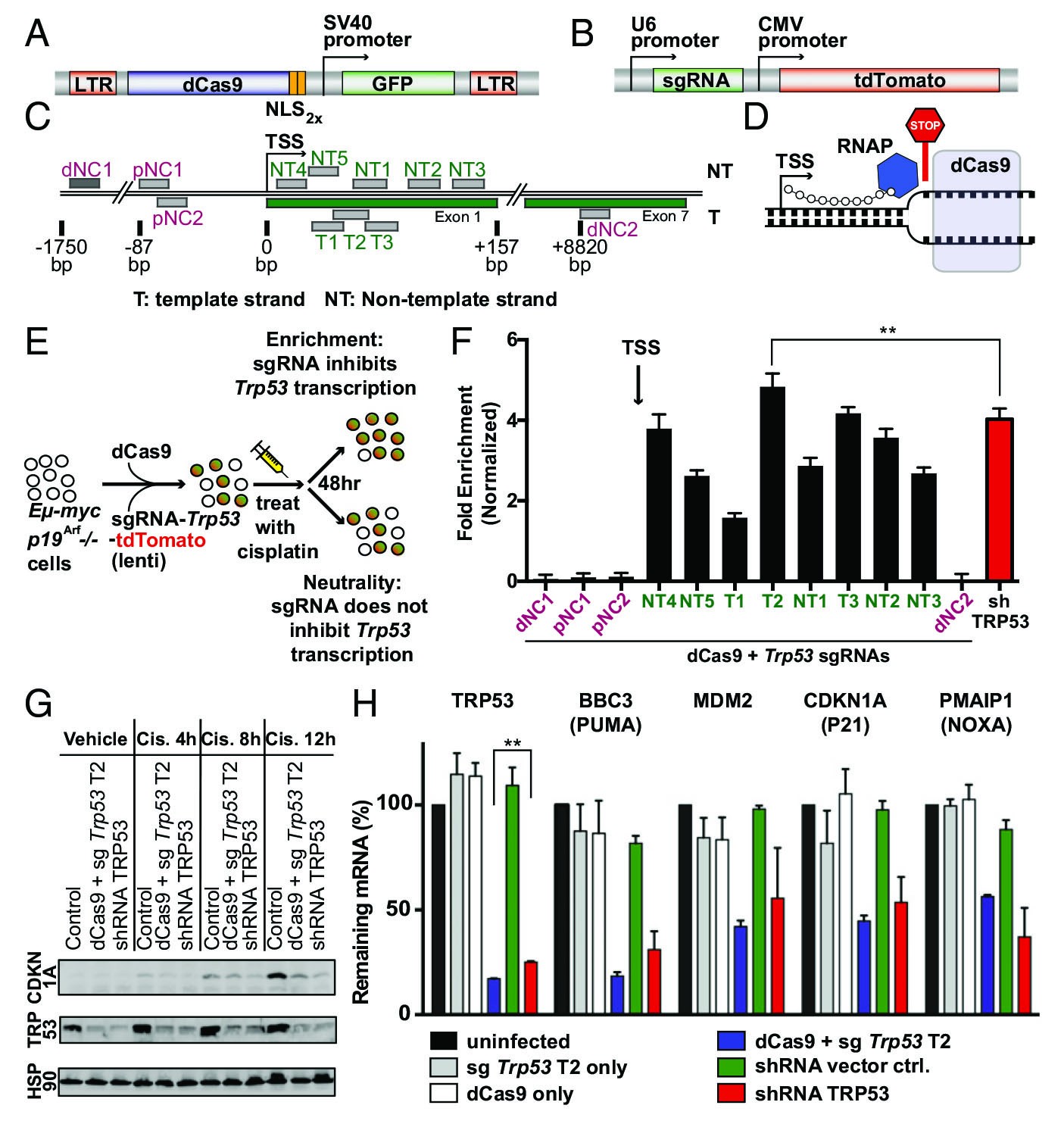
图 1.靶向 Trp53 的 TSS 的 dCas9 导致有效和可持续的 TRP53 功能丧失。
(A)MSCV-dCas9-GFP 的矢量图。
(B)U6-sgRNA-tdTomato 的矢量图。
(C)在鼠 Trp53 基因座上的 sgRNA 靶位点的概述。dNC,远端阴性对照,基于其距 TSS 的距离。pNC,近端阴性对照,基于它们相对于 TSS 的相对位置。绿色代表基于其在第一个外显子中,在 TSS 下游的位置预测被敲低的 sgRNA。
(D)由 RNA 聚合酶(RNAP)介导的 dCas9 介导的转录延伸中断的示意图。
(E)体外竞争测定的示意图。
(F)与 RNAi(shRNA TRP53)相比,顺铂处理后靶向 Trp53 基因座不同区域的单个 sgRNA 的标准化富集倍数。没有富集将导致归一化富集得分为零。
02
dCas9-VP64的Mgmt转录激活在体外和体内引起细胞对替莫唑胺的抗性
鉴于dCas9在体外和体内转录沉默TRP53,接下来作者想通过使用dCas9融合VP16转录激活因子(VP64)的四倍重复体来探索CRISPR介导的基因激活(CRISPRa)在体内的可行性(图2 A和B)。选择靶向编码一种自杀酶的Mgmt(O6-甲基鸟嘌呤-DNA甲基转移酶)基因(图2G)。作者设计了10个针对Mgmt TSS上游基因组区域的独特sgRNA(图2C),用dCas9-VP64和单个sgRNA转导了Bcr-Abl驱动的鼠急性B细胞淋巴白血病细胞(B-ALL),并通过qRT-PCR和Western blot检测分析了MGMT表达。多种sgRNA在mRNA和蛋白水平上均引起MGMT的强烈上调(图2 D和F)。为了确定观察到的基因激活是否赋予TMZ保护,针对TM4,T4和T6 sgRNA使用TMZ进行了体外药物给药,如预期的那样,所有sgRNA均赋予了对TMZ的抗性(图2H)。为了确定CRISPRa是否可以类似地用于体内模拟治疗反应,将感染了激活Mgmt转录(NT4,T6)或非靶向阴性对照(Gal4)的dCas9-VP64和sgRNA组合感染的B-ALL细胞移植到同基因和完全免疫能力的C57BL6 / 6J小鼠中(图2I)。根据疾病表现用TMZ或媒介物治疗小鼠,在没有治疗的情况下,Mgmt的转录激活对小鼠的存活率没有显着影响(图2J),而MGMT的表达增加导致对TMZ治疗的显着耐药性以及带有表达sgRNA的荷瘤小鼠的存活期明显缩短(图3K)。因此,dCas9与转录激活因子VP64的融合可用于增加MGMT的表达水平,并可快速模拟遗传改变对体内免疫功能正常的模型系统治疗的影响。
图 2. dCas9 与靶向 Mgmt TSS 上游基因组区域的 VP64 激活域的融合体介导替莫唑胺抗性。
(A+B)MSCV-dCas9-VP64-GFP(A)和 U6-sgRNA-tdTomato(B)的质粒图谱。
(C)靶向 TSS 上游的 Mgmt 的 sgRNA 的基因组结合位点的示意图。
(D)显示产生转录激活的 dCas9-VP64-GFP 的示意图。
(E)通过 qRT-PCR 评估的 dCas9-VP64 和归一化为 Gal4 阴性对照的多个 sgRNA 对 MGMT mRNA 的倍数上调。
(F)蛋白质印迹分析显示了用不同的 sgRNA 转录激活后的 MGMT 蛋白表达(ae,替代暴露)。(G)MGMT 的酶功能示意图。
(H)在有或没有 Mgmt 转录激活的情况下体外处理的 B-ALL 细胞的剂量反应曲线。
(I)描述了将 B-ALL 细胞体内移植到具有免疫功能的同基因 C57BL / 6J 小鼠中的过程。(J)带有或不带有 Mgmt 诱导以及媒介物或 TMZ 处理(K)后的曲线图。
03
CRISPRi具有最小的脱靶效应,且敲低是特异的
在该模型中,Cre-lox重组后,两个sgRNA的基因组结合位点得以保留,而几个下游Trp53编码外显子被删除,从而消除了TRP53参与下游效应子途径的能力(图3A)。因此,Trp53 sgRNA诱导的基因表达的任何变化都可以认为是偏离目标的。靶向并成功抑制Rev3l转录,可以在该细胞系中实现dCas9介导的敲除,进行RNAseq并比较用Trp53 sgRNA T2 / T3或对照Gal4 sgRNA转导的细胞的转录组分析,可以看到,不是通过sgRNA进行聚类,而是通过生物学复制发生聚类,这表明观察到的sgRNA之间的表达差异很小(图3B)。为了更好地量化潜在的脱靶转录本变化,在所有重复序列的三个sgRNA之间搜索了明显不同的转录本。仅有三份(Gal4对Trp53 T2)和一份(Gal4对Trp53 T3)转录物具有显着差异表达(图3 C和D),但T2和T3 Trp53 sgRNA之间检测不到任何差异表达的转录本(图3E)。可以表明,对于Gal4 sgRNA而言,缺乏完美匹配的结合位点使得可以实现Trp53 sgRNA所不存在的少量混合水平,而存在完美的基因组匹配。
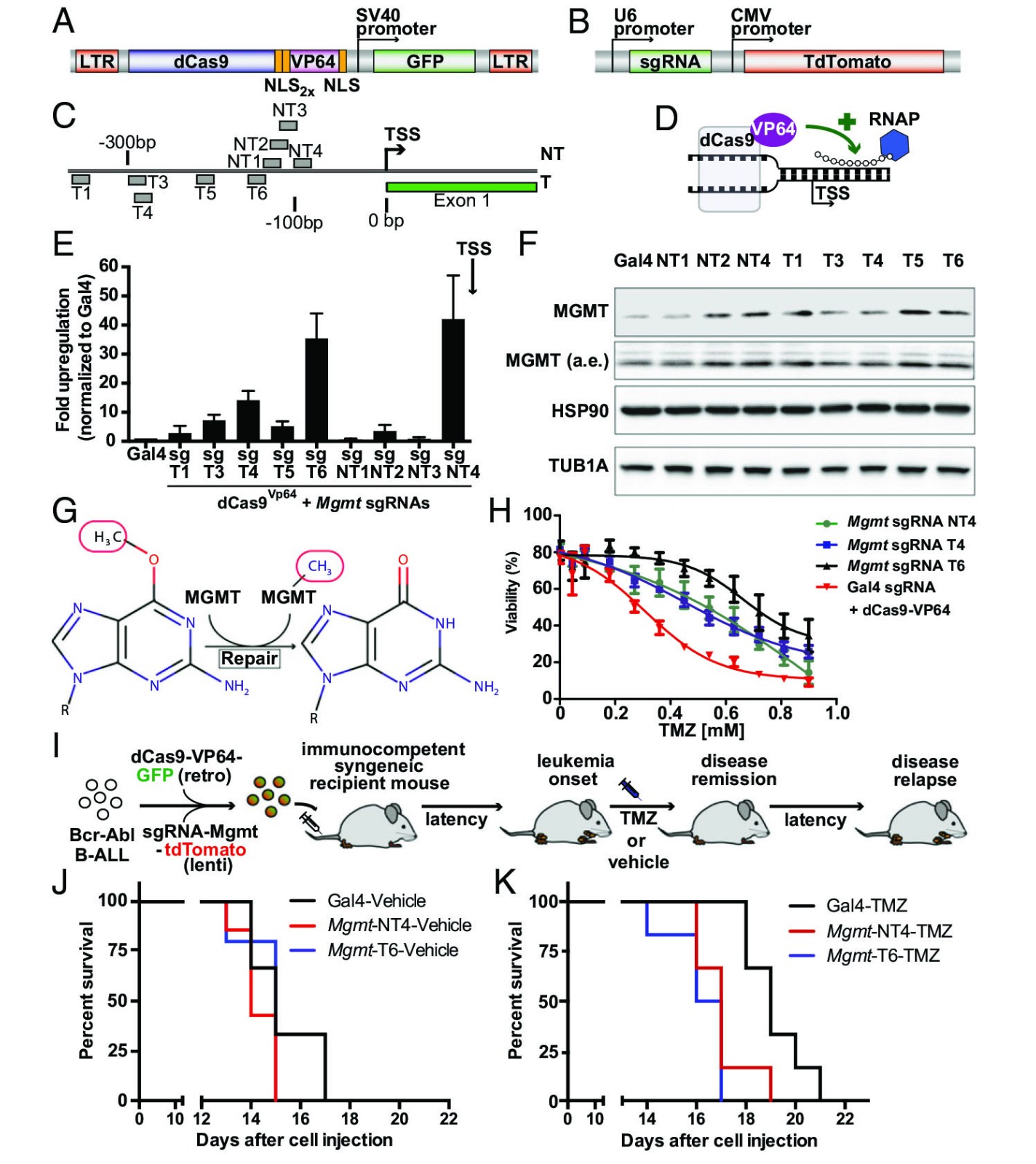
图 3. CRISPRi 敲低是特异的且脱靶效应最小。
(A)Trp53 的外显子 2–10 丢失;Trp53fl/fl(KP)鼠肺腺癌细胞允许 T2 和 T3 Trp53 sgRNA 结合而不会干扰 TRP53 的下游作用。
(B)用 dCas9 和靶向 Gal4(非靶向对照),Trp53 T2 或 Trp53 T3 的 sgRNA 稳定转导的 KP 细胞的分层聚类。文本通过复制着色。
(C+D)Trp53 T2 vs. Gal4(C),Trp53 T3 vs. Gal4(D)和 Trp53 T2 vs. Trp53 T3 的 MA 基因组图,具有显着差异调节的转录本,红色突出显示(FDR 调整后 P <0.01)
04
dcas9基因激活或抑制取决于结合区域与TSS的位置关系
鉴于dCas9具有激活和抑制靶基因表达的能力,为了确定单个构建体是否能够激活和灭活基因转录,将单独的dCas9或与VP64连接的dCas9靶向了ALL细胞中Trp53和Mgmt的TSS周围的不同基因组区域(图4A)。出人意料的是,如果靶向TSS的下游,VP64会失去其激活能力,并且相关的dCas9会作为转录障碍物而干扰转录延长,将dCas9-VP64靶向Mgmt TSS上游的基因组区域会导致有效的转录激活,但是将dCas9靶向该区域会导致MGMT mRNA水平显着下降(图4B)。为了确定dCas9-VP64抑制转录能力的一般性,创建了17个另外的sgRNA,它们靶向四个以上基因的相应TSS下游的基因组区域,这些都表现出显着的转录抑制(图4C)。为了探讨这些转录效应是否转化为功能表型,用顺铂或替莫唑胺处理ALL细胞,如转录水平的变化所预测,靶向Trp53外显子1的dCas9和dCas9-VP64均显示出对顺铂和替莫唑胺治疗的抗性表型(图4 D和E)。相反,只有dCas9-VP64激活Mgmt转录才导致细胞对替莫唑胺产生抗性。因此,得出的结论是,具有链接的VP64转录激活域的dCas9构建体可用于转录激活和抑制,这取决于其相对于TSS的相对位置。因此,只需改变目标DNA相对于相应TSS的位置,即可使用相同的dCas9蛋白互换执行CRISPRi和CRISPRa。
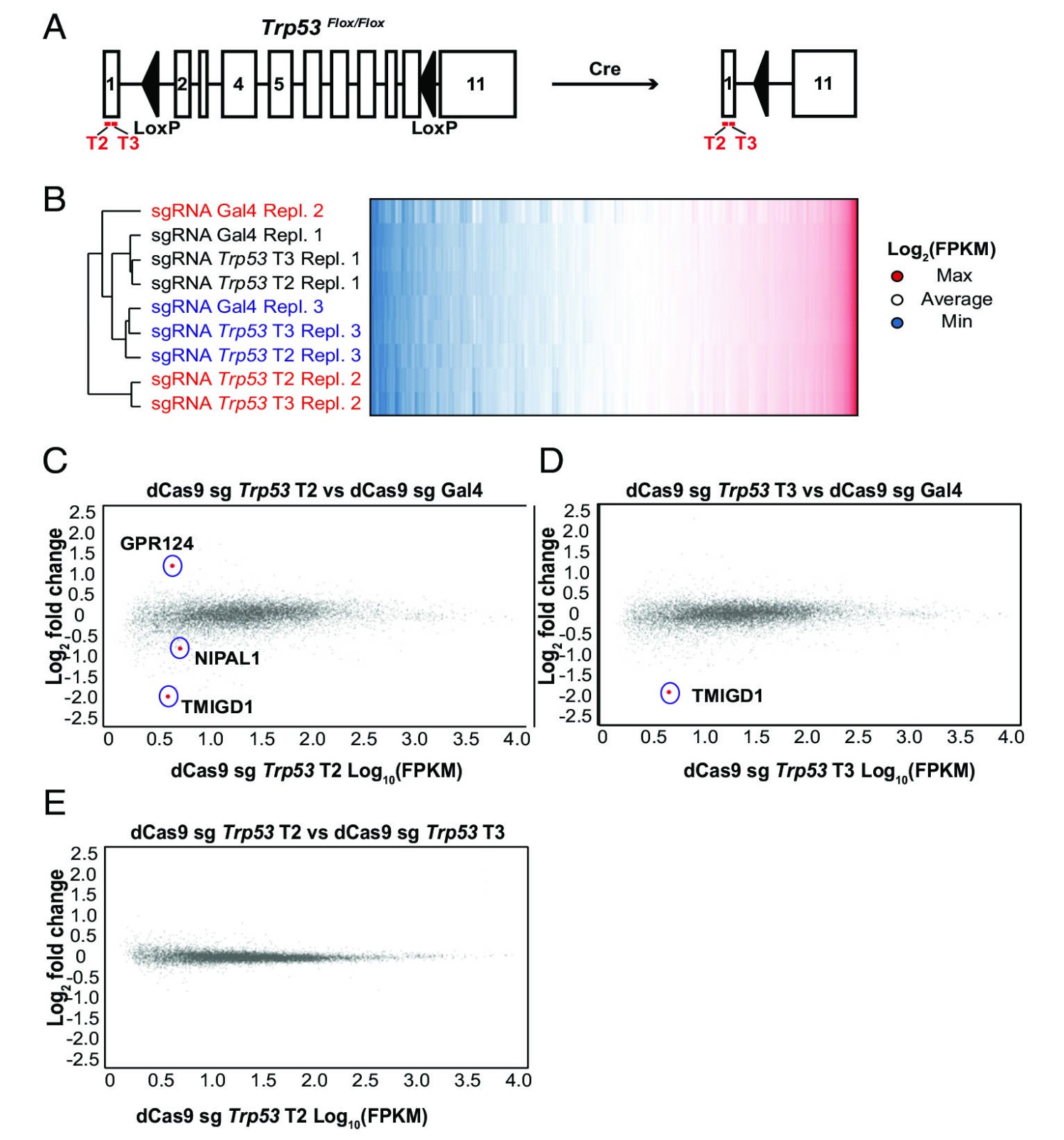
图 4.相对于 TSS 的基因组结合区域决定了 dCas9 的基因激活或抑制。
(A)示意图,显示 dCas9-VP64 充当基因转录的激活剂或抑制剂。
(B)通过 qRT-PCR 在用 dCas9 或 dCas9-VP64 和靶向 Gal4(阴性对照),Trp53 T2 或 Mgmt T6 的 sgRNA 转导的 B-ALL 细胞中评估的 TRP53 mRNA 水平。
(C)通过 qRT-PCR 在以 dCas9-VP64 和靶向 TSS 下游基因组区域的 sgRNA 转导的 B-ALL 细胞中评估的 mRNA 水平。
(D)用 dCas9 或 dCas9-VP64 和 sgRNA Gal4, Trp53 T3 或 Mgmt T6 顺铂转导的 B-ALL 细胞的剂量反应曲线。
(E)dCas9 或 dCas9-VP64 以及 sgRNAs Gal4,Trp53 T3 或 Mgmt T6 的 TMZ 转导的 B-ALL 细胞的剂量反应曲线。