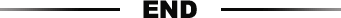广州市黄埔区学大道揽月路广州企业孵化器B座402
电话:020-85625352
手机:18102256923、18102253682
Email:servers@gzscbio.com
Fax:020-85625352
QQ:386244141
dcas9技术应用案例之三: 通过空间障碍功能调控基因正反义链的表达
日期:2020-03-04 标签:dCas9

CRISPRi是一种经过改造的CRISPR-Cas9系统,可作为链特异性障碍物,使用sgRNA靶向dCas9来抑制真核细胞中的转录,并为遗传干预提供了替代方法,以研究普遍的反义转录。在这里,作者成功使用点击化学方法构建了用于sgRNA表达的DNA模板,并显示了sgRNA / dCas9结合作用,而不是简单地充当障碍,它创造了允许转录起始/终止的环境,从而产生了新的正义和反义转录物。在酿酒酵母中针对HMS2非模板链进行反义转录的sgRNA / dCas9导致反义转录终止,一部分正义转录物的过早终止以及sgRNA / dCas9结合位点下游的新型反义转录物的起始。
01
使用点击化学制备sgRNA的DNA模板
CRISPRi介导的转录抑制需要成熟sgRNA和dCas9的共表达(图1A)。一个小的单链DNA文库,由sgRNA可变区的模板组成,使用点击化学方法(图1B)连接到恒定区,并成功地用作PCR模板,与对照全长相比,效率没有显着差异合成的寡核苷酸(图1C)。 将PCR产物插入内源性snR52基因座中的URA3选择盒中,以表达转录本,然后将其加工成成熟的核保留sgRNA(图1A)。尽管表达某些sgRNA的菌株生长较慢,且有生理作用(图1D),但在对照菌株中将URA3插入snR52或dCas9表达均不会影响生长速率。
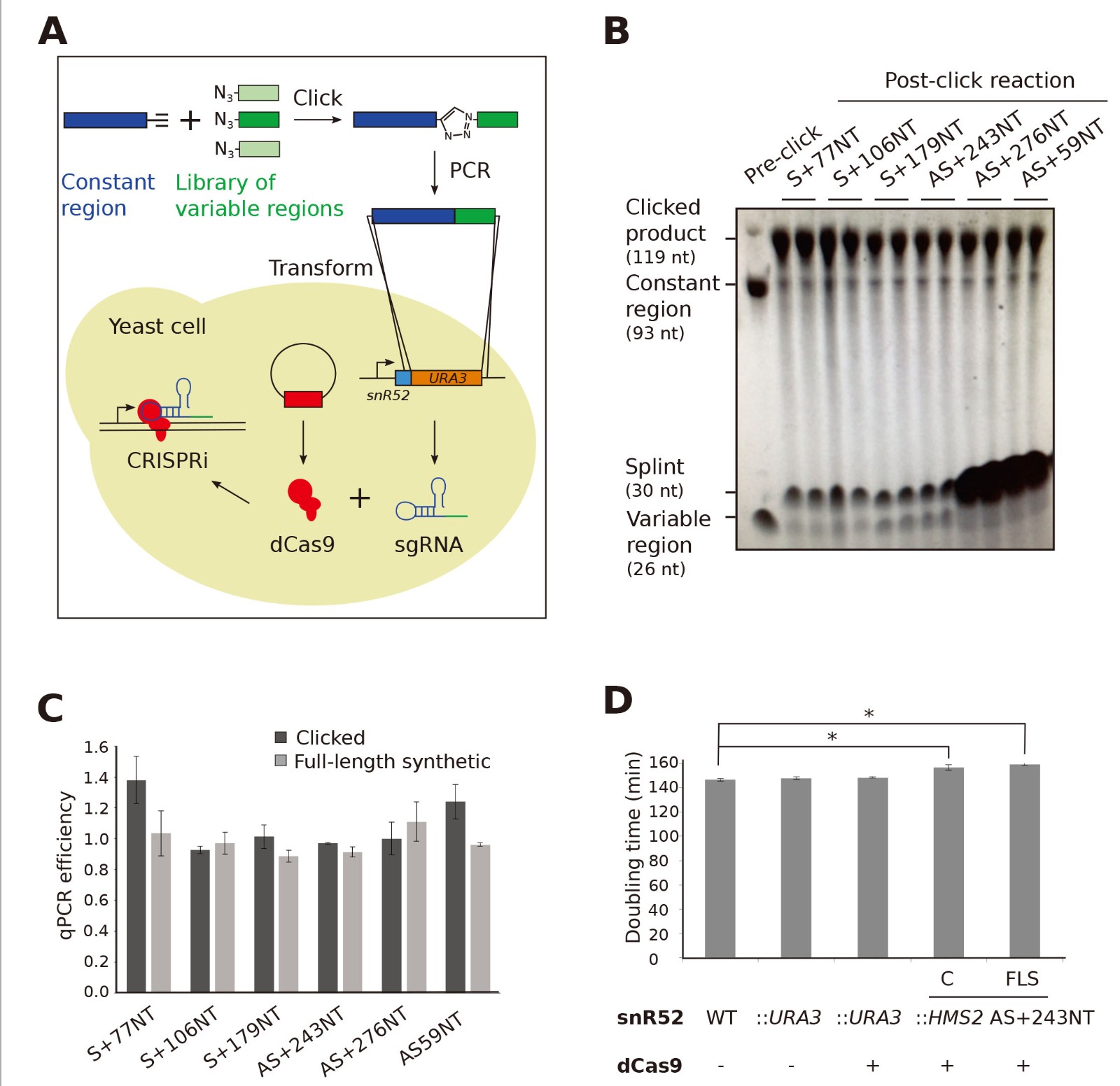
图1. sgRNA模板合成和掺入酵母的实验策略。
(A)实验概述。产生sgRNA的DNA模板是通过点击化学反应生成的,在带有编码恒定区的3'炔基的单链DNA寡核苷酸(深蓝色)和带有多个编码不同区域的5'叠氮基的单链DNA寡核苷酸(绿色)之间进行的,纯化所得的单链DNA寡核苷酸,通过PCR扩增,并转化到酵母中以替代先前已引入内源snR52基因座的URA3选择盒。sgRNA的表达由内源RNA聚合酶III snR52启动子驱动,并经过处理产生成熟的sgRNA。sgRNA与dCas9(红色)结合,在质粒的TDH3启动子的控制下表达,以阻止转录。
(B)通过UV阴影可视化的聚丙烯酰胺凝胶显示出所有HMS2构建体的点击反应效率很高。显示了可变区,DNA夹板,恒定区和点击产物的大小。
(C)图1所示的点击式和全长合成DNA寡核苷酸的PCR效率
02
CRISPRi抑制HMS2和GAL1基因反义转录物的产生
当sgRNA / dCas9靶向非模板(NT)链的PAM位点时,CRISPRi抑制转录(图2A)。首先,作者使用GAL1基因,该基因具有稳定的反义转录本(GAL1 AS)(图2B)。当GAL1基因被抑制时,GAL1 AS存在于含葡萄糖培养基中生长的细胞中,并且随着细胞切换到含半乳糖的培养基中含量降低(图2C 1-3道)。在邻近反义转录起始位点(TSS)的非模板链上设计了与两个PAM序列相邻的sgRNA(AS + 28NT和AS + 112NT)和特异性对照sgRNA(AS + 93T)(图2B),只有sgRNA AS + 112NT / dCas9导致GAL1反义转录水平显着降低(图2C,D)。
另外,针对具有稳定反义转录本SUT650的HMS2基因座设计了三种靶向SUT650的sgRNA,分别位于非模板链上主要SUT650 TSS下游59、243和276个核苷酸(分别为sgRNA AS + 59NT,AS + 243NT,AS + 276NT)(图2E)。AS + 243NT / dCas9显着降低了SUT650的表达(图2F泳道1和3,2G),这种抑制作用与单体和对照的全长合成构建体相当(图2G)。但是,其他两个sgRNA / dCas9对SUT650水平没有明显影响(图2F泳道1、4和5、2G)。GAL1和HMS2的这些结果证实CRISPRi适用于降低酵母中反义转录物的水平。
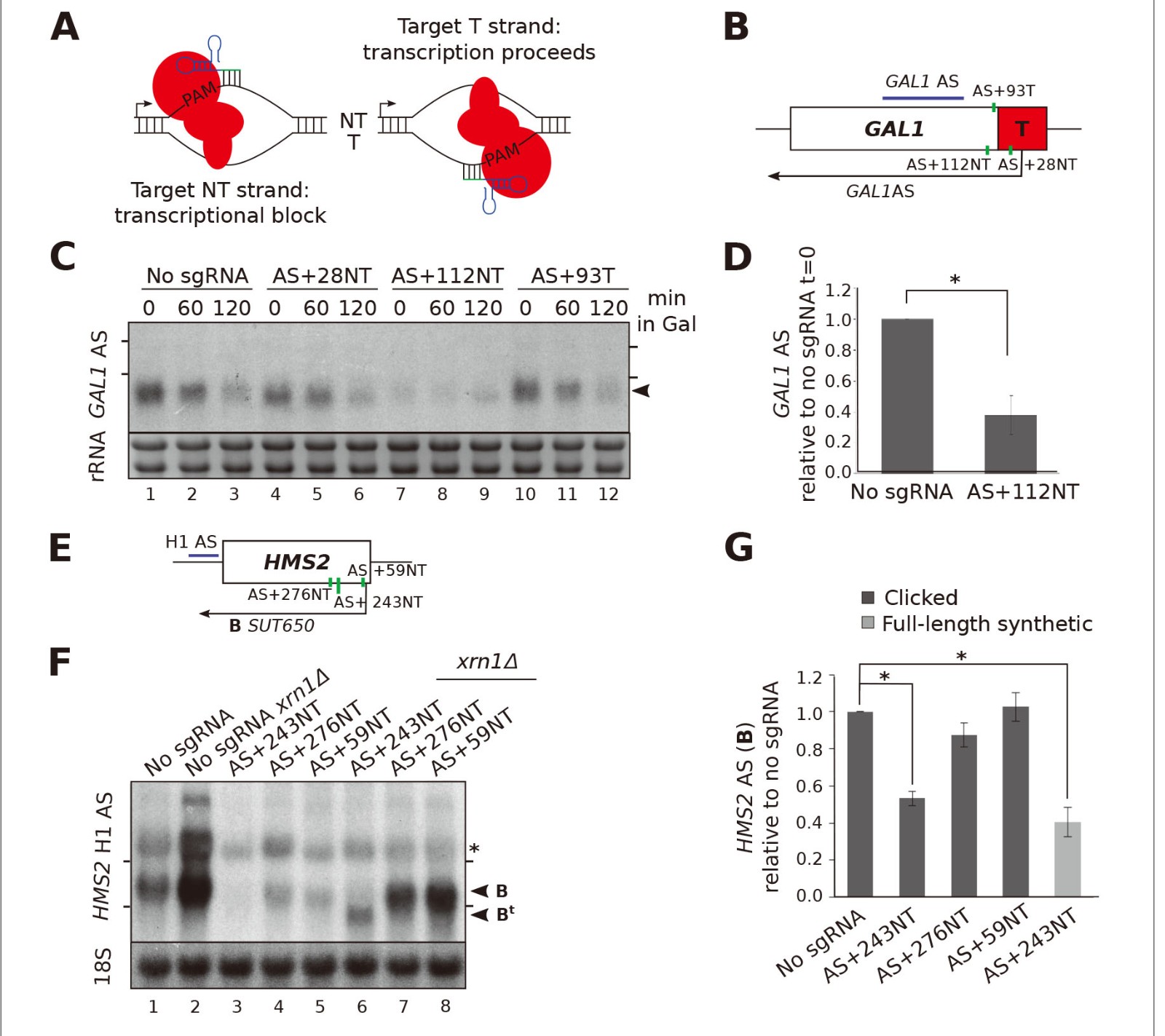
图2. CRISPRi减少了GAL1和HMS2的反义转录物。
(A)展示了先前报道的sgRNA / dCas9复合物对链特异性转录抑制进行非模板链靶向的要求的示意图。箭头指示转录方向。 NT,非模板; T,模板;红色,dCas9; PAM,原间隔物相邻基序;绿色/蓝色,sgRNA。
(B)工程GAL1基因座的示意图,显示了ADH1终止子的插入位点(T,红色框),稳定的GAL1反义转录物的转录起始位点和设计的靶向sgRNA的位置(绿色垂直线)
(C)Northern印迹,显示相对于无sgRNA对照(GAL1:ADH1t snR52 :: URA3 with dCas9),表达sgRNA AS + 112NT / dCas9的菌株中GAL1反义转录物(黑色箭头)减少。
(D)在无对照的sgRNA菌株和具有sgRNA AS + 112NT的菌株中,t = 0时GAL1 AS转录物的RNA印迹的定量。
(E)HMS2基因座图,显示HMS2 AS转录本,SUT650(黑色箭头,转录本B)和靶向SUT650的三个sgRNA的位置(绿色垂直线)。紫色线显示了用于检测SUT650(H1 AS)的Northern印迹探针的位置。
(F)Northern印迹,XRN1的缺失表达AS + 243NT的菌株中检测到较短的反义转录物(Bt)。
(G)定量表达相对于对照无sgRNA菌株的三种反义sgRNA的每一种的菌株中SUT650(转录物B)减少的水平。
03
HMS2和GAL1正义转录物受各自CRISPRi诱导反义转录物阻断的影响不同
作者检测了AS + 112NT / dCas9对GAL1 AS的抑制是否影响GAL1正义转录本,使用CRISPRi抑制GAL1 AS没有观察到GAL1正义转录水平有明显变化(图3A,B)。为了支持反义转录的链特异性转录阻滞,sgRNA AS + 112NT / dCas9不影响GAL1正义转录本polyA位点的使用(图3C)。该菌株中的XRN1缺失也不会影响polyA位点的使用,排除了部分双链转录阻滞以及随后导致的截短的正义转录物的不稳定(图3C)。
先前的研究表明,减少SUT650转录可提高HMS2有义转录水平。但是,通过AS + 243NT / dCas9阻止SUT650不会类似地增加HMS2(图3D,通道1和3)。除了全长HMS2正义转录本(A),还检测到HMS2正义转录本(At)大大缩短,与XRN1的存在无关(图3D,泳道1和3或2和6),因此假设AS +结合在HMS2编码区内的243NT / dCas9复合物可能会导致部分过早的正义转录终止,从而导致转录本At。因此,作者通过使用横跨位点的一系列链特异性探针,通过Northern印迹法绘制了HMS2 S的3'端图(图3E)。
图3. HMS2和GAL1正义转录物受各自反义转录物阻断的影响不同。
(A)Northern印迹,在没有sgRNA的对照菌株(带有dCas9的GAL1 ADH1t snR52 :: URA3)和表达sgRNA AS + 112NT / dCas9的菌株中检测GAL1正义转录本(黑色箭头)。
(B)在t = 90时(A)中所示的RNA印迹的定量。
(C)显示了在所示菌株中通过RACE进行的GAL1正义转录物3’末端定位的结果的示意图。转录物切割和聚腺苷酸化发生在所示的GAL1 AS阻断AS + 112NT sgRNA的位置之外(绿色垂直线)。
(D)用HMS2正义探针H1(紫色)探测的Northern印迹,显示了无sgRNA对照(带有dCas9的snR52 :: URA3)菌株和表达所示反义靶向的菌株中HMS2正义(黑色箭头,转录物A)的水平sgRNA。在表达AS + 243NT的菌株中也检测到截短的有义转录本(At)。
(E)用一系列HMS2正义特异性探针进行Northern印迹,检测示意图中指示的区域。显示了sgRNA AS + 243NT / dCas9结合位点的位置(绿色垂直线)。