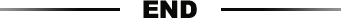DNA甲基化文献赏析之三: TET酶通过对Aicda超级增强子上的5-hmC修饰增强活化诱导的脱氨酶(AID)表达
联系电话:020-85625352
Email:servers@gzscbio.com

摘要:
TET酶是双加氧酶,其通过将5-甲基胞嘧啶的甲基氧化成5-羟甲基胞嘧啶(5hmC)来促进DNA去甲基化。在这里,作者报道了在B细胞中5hmC标记区域、染色质可及性和增强子活性之间的密切关系,以及强烈富集在TET响应基因组区域的碱性区域 - 亮氨酸拉链(bZIP)转录因子的共有结合基序。Aicda基因编码节鼠B细胞中的类别转换重组(CSR)所必需的激活诱导的胞苷脱氨酶(AID)酶,AID分别通过在Ig开关区域产生DNA双链断裂和在Ig可变区域产生点突变来促进CSR。由于其高致突变潜能,AID的表达通常局限于活化的B细胞,并受到严格的调控。在功能上,Tet2和Tet3通过增强Aicda的表达来调CSR。TET酶沉积5hmC,促进DNA去甲基化,并维持染色质可及性,这两种TET反应性增强子元件TetE1和TetE2位于Aicda基因座的超增强子中。本文数据鉴定了bZIP转录因子,ATF-like(BATF)作为参与TET依赖性Aicda表达的关键转录因子。在活化的Batf缺陷型B细胞中5hmC未在TetE1中沉积,表明BATF促进TET募集至该Aicda增强子。本研究强调TET酶对促进AID表达的重要性,并强调5hmC作为表观遗传标记,捕获细胞激活过程中的增强子动力学。
1、B细胞活化促进5hmC的全基因组沉积。
用胞嘧啶-5-亚甲基磺酸盐(CMS-IP)抗体免疫沉淀基因组DNA,分析用脂多糖(LPS)和白细胞介素-4(IL-4)激活的小鼠B细胞中5hmC沉积的动力学,用于研究CSR的充分表征的体外系统(图1A)。绝大多数5hmC标记的区域(~160,000)在活化前和活化后的B细胞之间共享(图1B)。72小时激活的B细胞与幼稚B细胞中约9500个差异羟甲基化区域(DhmRs)中,大多数(8454)增加了5hmC(DhmR72h-up),而更少数量(928)减少了5hmC(DhmRdown) )(图1B和C)。DhmRs通常距离最近的转录起始位点(TSS)超过10kb并且它们的5hmC水平在激活后随时间逐渐变化[DhmR72h-up(图1D)和DhmR72h-down(图S1C)。由TET蛋白产生的5hmC是DNA去甲基化中已知的中间体。为了将5hmC与DNA甲基化的变化联系起来,作者比较了在幼稚和72-后激活的B细胞中5hmC分布与已发表的全基因组亚硫酸氢盐测序(WGBS)数据,在相似条件下激活48小时的B细胞。虽然WGBS不能区分5mC和5hmC,但5hmC通常是5mC的小部分(1到10%),因此,在这里将WGBS信号称为“DNA甲基化”。在24,48和72小时显示增加的5hm的区域(DhmR24h-up,DhmR48h-up和DhmR72h-up)也显示DNA甲基化减少(图1E)。总的来说,5hmC沉积的区域对应于B细胞活化期间DNA低甲基化的区域。DhmR72h-up和DMR48h-down区域的基序富集分析显示,两者均富含核因子B(NF-B)(Rel同源结构域)和bZIP家族转录因子的共有结合序列即“复合”IRF:bZIP基序(图1F)。为了辨别5hmC和增强子之间的关系,作者对幼稚和活化的B细胞增强子进行了分层,由H3K4单甲基化(H3K4me1)定义,基于H3K27乙酰化水平(H3K27Ac),一种跟踪增强子活性的修饰。相对于平衡的(H3K4me1+H3K27Ac-)增强子,5hmC在活性(H3K4me1+H3K27Ac+)中最高度富集(图1G)。此外,由H3K27Ac定义的活化B细胞中超过75%的先前鉴定的超级增强剂与至少一个DhmR72h-up区域重叠(图1H):例如,Ccr4基因座处的3'远端元件显示5hmC和H3K27Ac的激活依赖性增加,伴随着特定CpGs甲基化的丧失和mRNA表达的增加(图1I和J)。以上的数据显示5hmC修饰和DNA去甲基化与B细胞活化期间的增强子活性相关。
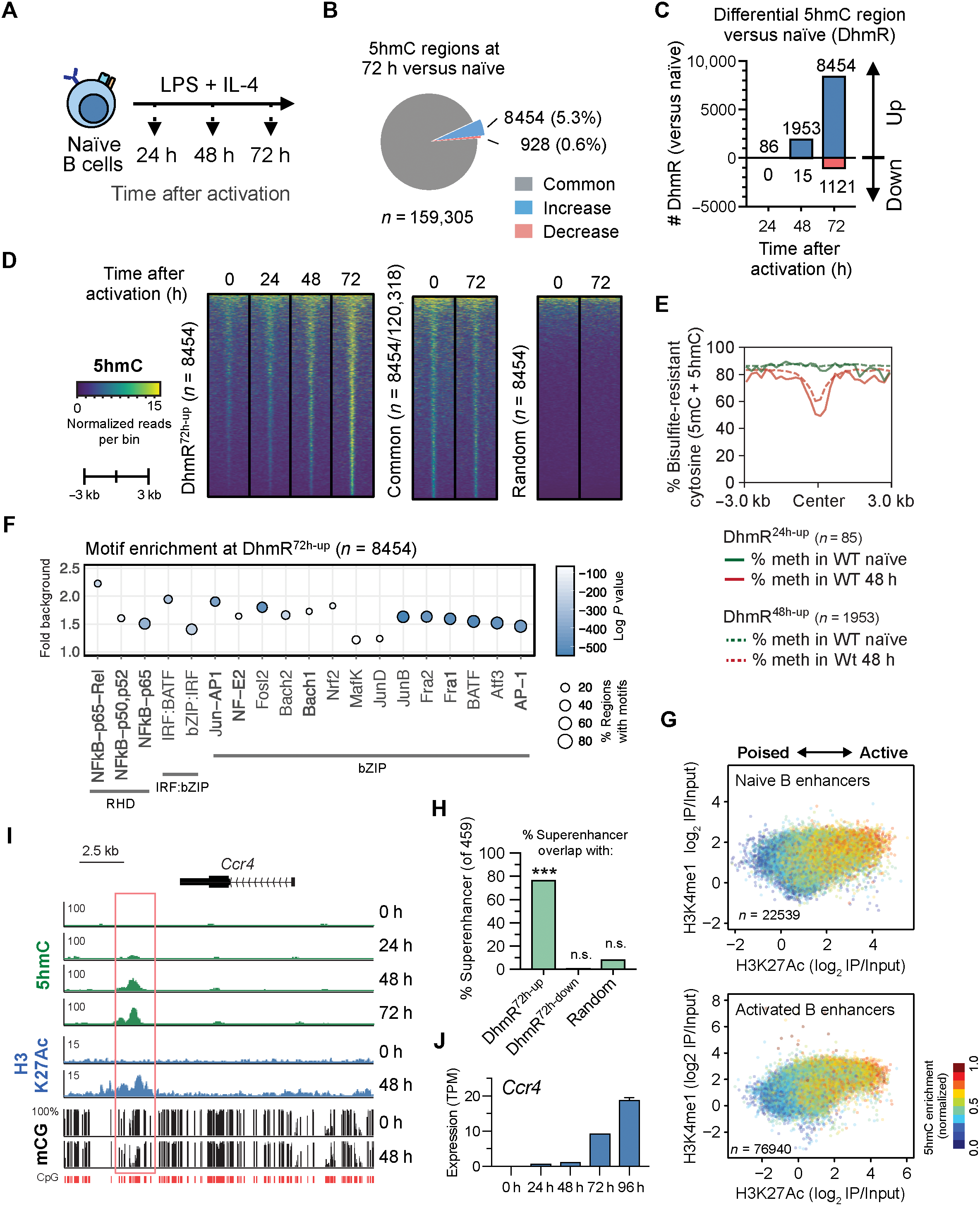
图1. B细胞活化期间5hmC的动态变化。
A.实验流程图。
B.未刺激和活化的B细胞中5hmC富集区域之间的比较(72小时)。
C.DhmR的数量。
D.DhmR72h-up(左)中5hmC修饰的动力学。相同数量的随机选择的共同5hmC标记区域(中间)和随机区域(右)没有增加。5hmC富集显示为每100bp bin的标准化读数。
E.相对于幼稚B细胞,在24h和48h激活的B细胞中增加5hmC的85和1953区域在48小时后在其中心显示减少的“甲基化”,计算6kb的每个200bp箱的平均甲基化。
F.DhmR72h-up的基序富集分析。常用的5hmC富集区域用作分析背景。该y轴表示相对于背景的倍数富集,圆形大小表示含有相应基序的区域的百分比,颜色表示显着性(log10 P值)。
G.相对于活化和幼稚B细胞中的平衡(H3K4me1 + H3K27Ac lo)增强子,5hmC富含活性(H3K4me1 + H3K27Ac hi)。
H.通过高H3K27Ac富集鉴定的大部分超级增强子(352个,459个,76.7%)与DhmR72h-up重叠。
I.Ccr4基因座(mm10; chr9:114,484,000至114,501,000)作为活化后具有增加的5hmC,增加的H3K27Ac和减少的CpG甲基化的区域的实例。
J.活化的B细胞中的动力学Ccr4 mRNA表达(通过RNA-seq)。
2、TET2和TET3是调节B细胞中CSR的主要TET蛋白
(1)野生型和Tet2/3双缺陷B细胞的比较鉴定了TET响应性调节元件
TET2和TET3是B细胞中表达的两种主要TET蛋白(图2A)。为了评估TET蛋白在调节B细胞功能中的作用,用他莫昔芬处理CreERT2Tet2fl/flTet3 fl/fl Rosa26-YFPLSL 5天以敲除Tet2和Tet3(双敲除,DKO)。Tet2fl/fl Tet3 fl/fl Rosa26-YFPLSL野生型(WT)小鼠用作对照; YFP报告Cre表达。分离B细胞并用LPS和IL-4活化(图2B),Tet2细胞和Tet3均在B细胞中有效缺失(图2C),YFP+细胞显示出相似的成熟脾滤泡B细胞频率(图2A和B)。在激活72h时,大约2300个5hmC富集区域在WT和DKO之间显着不同,与Tet2 / 3DKO B细胞相比,在对照中显着更多区域获得5hmC(图2,D和E),大多数距离最近的TSS> 10 kb(图S2D)。在与Tet2/3 DKO B细胞(“WT> DKO DhmR”)相比,WT中具有更高5hmC的2139“TET调节的”DhmR中,2020(94.4%)与DhmR72-up区域显着重叠,大多数显示在富含RHD,bZIP和复合IRF:bZIP基序(图2F)。

图2.WT和Tet2 / 3DKO B细胞中5hmC修饰的比较。
A.TET家族成员(来自RNA-seq)的平均mRNA表达。
B.小鼠的描述和实验流程图。
C.有效删除Tet2和Tet3。通过qRT-PCR分析来自他莫昔芬处理的WT对照和Tet2/3 DKO小鼠的B细胞中的Tet2和Tet3表达。
D.WT和Tet2 / 3DKO B细胞之间富含差异5hmC的区域(DhmR)的数目。
E.在WT和DKO之间在DhmRs72h从WT(左)和Tet2/3DKO(右)富集5hmC的动力学。 DKO中5hm降低的区域如上所示(WT> DKO),5hmC升高的区域如下所示(DKO> WT)。
F.DhmR72h-WT> DKO的基序富集分析(如图1F中分析)。
(2)TET2和TET3调控Ig CSR
为了评估Tet2/3缺失对体内抗体反应的影响,我们用4-羟基-3-硝基苯乙酰基偶联卵清蛋白免疫前用Tamoxifen处理Tet2 fl/fl Tet3 fl/fl Rosa26-LSL-YFP CreERT2和对照小鼠。 (NP-OVA)(图3A)。WT和DKO的GC B细胞(CD19 + GL7 + Fas +)的总百分比相似(图3,B和C),但NP特异性B细胞的频率显着增加(图3D)。因为使用CreERT2系统的急性Tet2/3缺失影响多种细胞类型,所以没有在Tet2f1/f1Tet3f1/f1 CreERT2Rosa26YFPLSL小鼠中进一步研究体内B细胞表型。然而,这些小鼠中最值得注意的表型是从IgM到IgG1的CSR持续减少(图3,E和F),证明了TET蛋白在体内调节抗体反应中的作用,特别是CSR。要确定是否CSR表型是B细胞内在的,来自他莫昔芬处理的小鼠的B细胞用增殖追踪染料(CellTrace Violet)标记,并用LPS和IL-4活化4天(图3G)。与体内CSR缺陷一致,体外Tet2/3 DKO B细胞中的IgG1转换始终低于WT B细胞(图3,H和I)。与CSR减少相关,Tet2/3 DKO B细胞中环状γ1 RNA的表达降低(图3J)。此外,相对于WT B细胞,Tet2/3 DKO中的CSR至IgA也降低(图3K-N)。Tet2CD的酶失活突变体(Tet2CDHxD)也部分恢复CSR,表明TET酶活性和支架功能在CSR中起作用(图3G-I)。这些结果表明Tet2和Tet3是体外和体内最佳CSR所必需的。
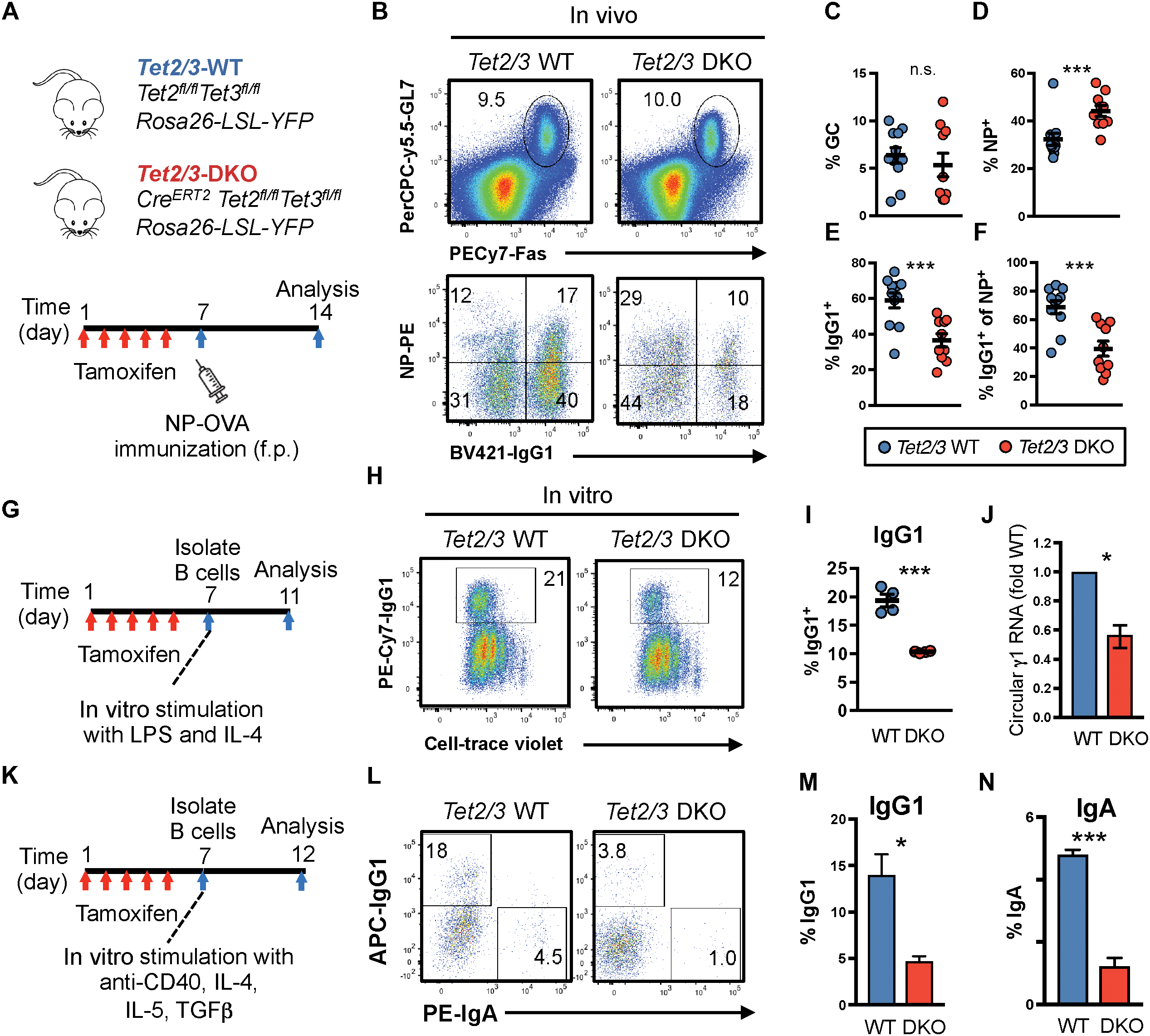
图3. TET蛋白促进CSR。
A.体内实验的流程图。
B.上图:在如(A)中的NP-OVA免疫后,来自WT和Tet2 / 3DKO小鼠的引流性pop淋巴结处的CD19 + GL7 + Fas + GC B细胞的流式细胞术分析。下图:与WT小鼠(GC B-门控)相比,Tet2 / 3DKO(YFP + GC B-门控)中GC B细胞中的IgG1转换细胞减少。
C-F.(B)中所示的实验的定量。显示的数据是来自两个独立实验的汇总结果。
G.体外IgG1转换的流程图。用细胞痕量紫标记细胞,并用LPS和IL-4活化4天。
H和I.Tet2/3 DKO和WT小鼠中IgG1转换的B细胞的流式细胞术图(H)和定量(I)。
J.通过qRT-PCR定量环状γ1 RNA水平。
K.体外IgA转换的流程图。用抗-CD40,rmIL-4,rmIL-5和rhTGF +将细胞活化5天。
L-N.IgG1转换(M)和IgA转换细胞(N)的流式细胞术图(L)和定量(M和N)。
3、TET2和TET3通过远端增强子上的TET响应调节元件调节AID的表达
(1)TET2和TET3调节胞苷脱氨酶AID的表达
CSR是一种高度调节的过程,涉及多种途径。RNA测序(RNA-seq)分析鉴定了WT和Tet2/3 DKO B细胞之间差异表达的相对少量的基因,其中包括编码AID的Aicda,这是一种对CSR至关重要的蛋白质。qRT-PCR和Western印迹分析证实激活后Tet2/3 DKO中Aicda mRNA相对于WT B细胞减少> 50%(图4A和B)。为了确定AID表达的减少是否是CSR缺陷的完全原因,作者表达了WT和催化失活的AID(AIDH56R / E58Q),WT和Tet2/3 DKO B细胞通过逆转录病毒转导,催化活性AID(AIDWT)的逆转录病毒表达,但不是无活性的AIDH56R / E58Q,在很大程度上挽救了Tet2 / 3DKO B细胞中的CSR缺陷(图4C和D,下图)。与先前的观察结果类似,WT细胞中AID的表达也增加了IgG1+细胞的频率(图4,C和D,左上图和中图)。由于Tet2/3不是表达CSR和ger1种系转录本所必需的,Tet2/3 DKO B细胞中大部分CSR缺陷可归因于Aicda Mrna和AID蛋白表达的降低,导致测试TET蛋白通过Aicda基因的远端调控元件控制Aicda表达。
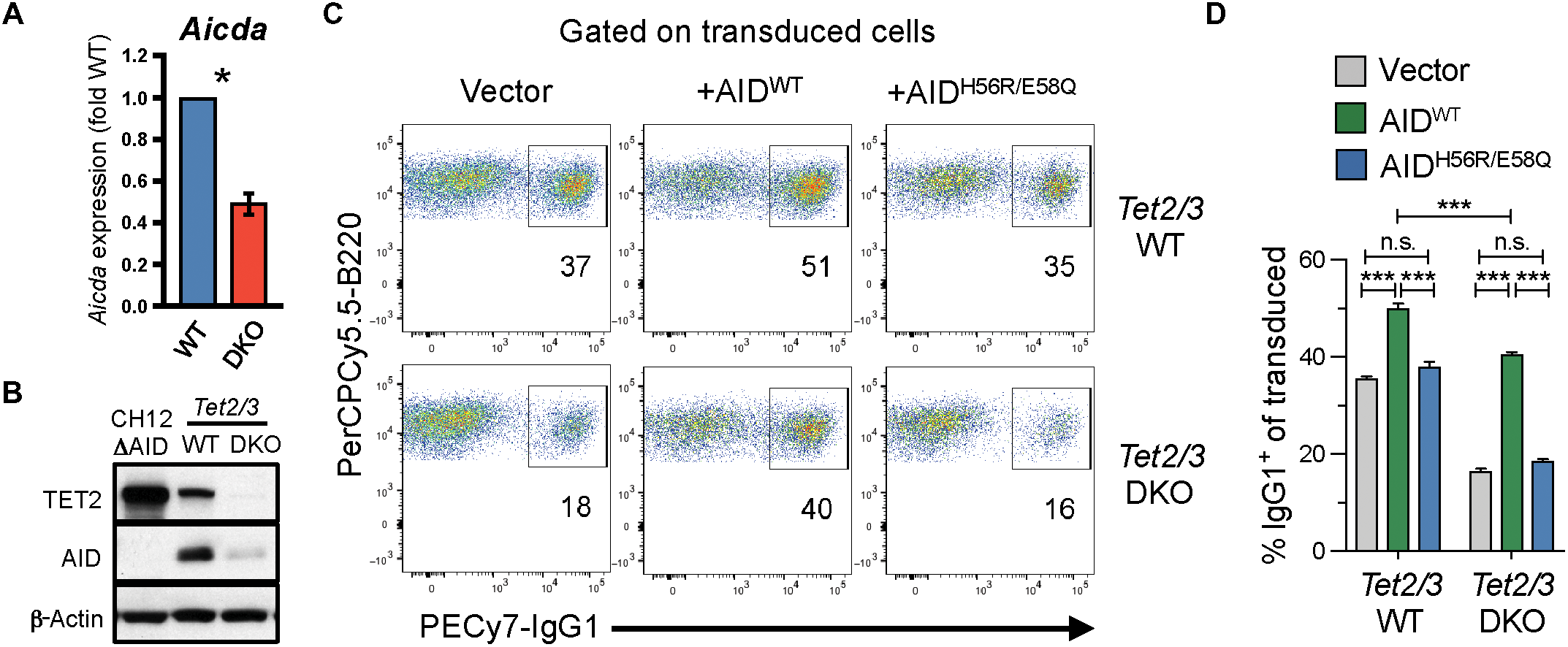
图4.TET2/3通过调节胞苷脱氨酶AID的表达促进CSR。
A.用LPS和IL-4活化4天的WT和Tet2/3 DKO B细胞中Aicda mRNA表达的qRT-PCR分析。
B.来自第4天的全细胞裂解物的免疫印迹活化的WT和Tet2 / 3DKO与指定的抗体。
C和D.用空载体(Thy1.1,左),WT AID(AIDWT,中间)或催化失活的AID(AIDH56R / E58Q,右)转导WT和Tet2 / 3 DKO B细胞。
(2)全基因组分析识别Aicda基因座中的TET响应调节元件
多个保守调节元件影响Aicda表达(图S5A),其中Mfap5基因中-26kb的Aicda 5'增强子,基因间5'增强子和内含子1增强子显着增加H3K27Ac并在激活时损失5mC,并且统称为Aicda“超级增强子”(图5A)。TET2的ChIP-seq显示这些调节元件中的每一个都被激活的B细胞中的TET2占据(图5A)。这些-26kb Mfap5内含子区和-8kb 5'基因间区域(此处分别称为TetE2和TetE1)受TET调节,B细胞活化诱导5hmC的TET依赖性增加(图5B),将它们放在WT> DKO DhmRs的类别中(图2D和E)。TetE1似乎是TET2/3的主要靶标,因为它在激活后具有更大的5hmC增益(图5B)。相比之下,Aicda启动子等区域甚至在激活前标记为5hmC,表明这些区域的5hmC可能在B细胞分化的前一阶段产生,然后维持到幼稚外周B细胞的出现。B细胞活化在TetE1诱导强H3K27Ac和DNA去甲基化(图5A)。 因为亚硫酸氢盐测序不能区分5mC和5hmC,作者使用氧化亚硫酸氢盐测序(oxBS-seq)来评估WT和Tet2/3 DKO细胞中TetE1的5mC,5hmC和未修饰的C水平,TetE1和Aicda启动子中的CpG在活化前显示出相似的5mC和5hmC水平(图5C,比较0小时图)。 在活化后72小时,WT B细胞中5mC显着降低,相反TetE1和Aicda启动子都在Tet2/3 DKO B细胞中甲基化(图5C,下图;比较72小时图)。这些结果表明TET2和TET3通过结合并在TetE1和TetE2处沉积5hmC来调节Aicda表达。
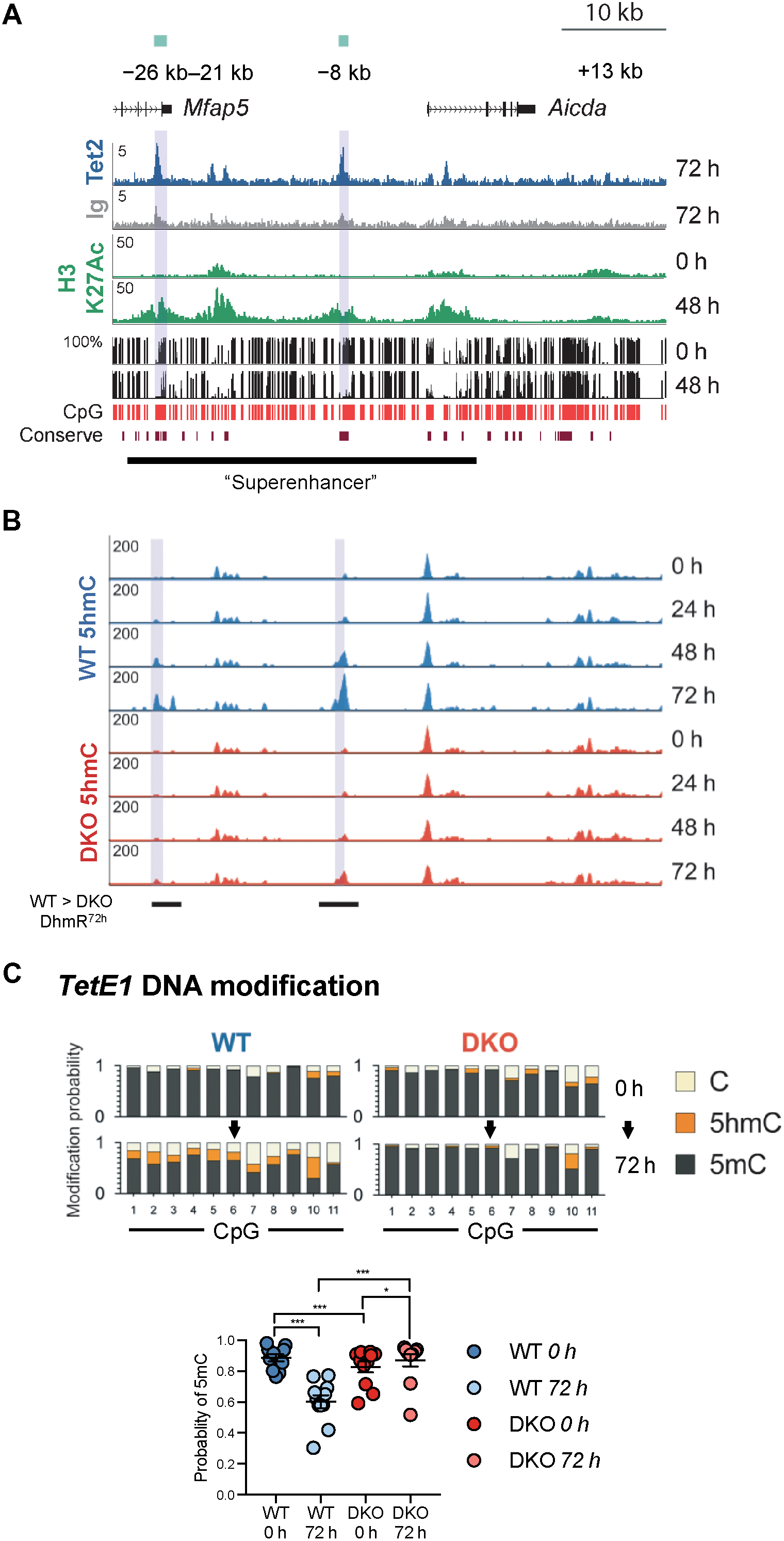
图5.TET2和TET3通过TET反应元件TetE1和TetE2控制Aicda表达。该图显示了位于Aicda基因5'的两个保守的TET反应元件TetE1和TetE2(用绿色矩形和灰色阴影标记)。A.前两个轨迹:ChIP-seq分析,与Ig对照(灰色)相比,激活后TET2(蓝色)特异性结合Aicda基因座中的多个元件。中间(绿色):激活后增加H3K27Ac。底部:激活诱导TetE1和TetE2处的DNA去甲基化。WGBS显示幼稚和48小时激活的B细胞(mCG;黑色)中的DNA甲基化(5mC + 5hmC)。
B.在Aicda远端元件处的活化诱导的TET2/3依赖性5hmC沉积。显示了72小时活化后WT和DKO之间差异的5hmC富集区域(WT> DKO DhmR72h)。
C.TET2/3沉积5hmC和去甲基化TetE1。上图:在激活之前(0小时)和之后(72小时),使用从WT和Tet2 / 3DKO B细胞分离的DNA,通过oxBS-seq分析TetE1处的CpG修饰(5hmC,5mC和C)。底部:定量在TetE1中对所有CpG进行5mC修饰的概率。
(3)TET2和TET3维持两个Aicda TET反应元件TetE1和TetE2的染色质可及性
活性调节区通常存在于染色质的可及区域并以标记。为了评估染色质可及性的动态,作者在用LPS和IL-4刺激的B细胞中进行ATAC-seq。WT> DKO DAR富含bZIP和BATF:IRF基序,类似于DhmR72h-up(图1F)和WT> DKO DhmRs(图2F)中的那些。着眼于Aicda基因座,我们发现激活与Aicda增强子TetE1和TetE2的可及性增加有关。 5hmC修饰在这两种元素下连续增加直至72小时,在TetE1处具有更高水平的沉积(参见图5B)。相比之下,染色质可及性增加的时间过程在两种增强剂上差异很大:TetE2在激活后24小时显示可及性快速增加,而TetE1可及性增加的时间过程较慢,匹配5hmC沉积(比较图5B和图S6D)。这些数据表明bZIP家族转录因子,TET催化活性和染色质可及性之间的一致联系。
4、BATF在Aicda增强剂的TET上游起作用
在开发细胞谱系规范或激活过程中建立增强子之前,某些关键转录因子与核小体相关区域结合并募集染色质重塑复合物和组蛋白修饰酶以产生活性增强子。为了识别Aicda基因座的潜在先驱转录因子,利用了先前的基序富集分析(图1F和2F以及图S1G)观察到bZIP转录因子共有结合基序的强烈富集,在逐渐增加5hmC作为激活函数的区域(图1F,DhmRup),与Tet2/3DKO B细胞相比,WT中5hmC高的区域(图2F,WT> DKO DhmRs)和WT对Tet2/3 DKO B细胞具有更高可及性的区域。在这些数据的基础上,作者关注在活化B细胞中表达的bZIP转录因子,与之前的观察结果一致,Batf mRNA和蛋白在激活后被诱导(图6A和图S8B),并且它们的表达先于Aicda的表达。两个可区分的BATF ChIP seq峰中的一组(图6B中的簇2)被TET调节,因为该簇中的峰显示在激活后5hmC中依赖于TET2/3依赖性的增加(图6B和C)相反,簇1中的BATF峰显示在5hmC中没有显着的活化依赖性增加(图6B,上图)。总体而言,激活诱导的5hmC(DhmR72-up)与BATF峰重叠的区域重叠,表明除了BATF之外,其他转录因子也有助于在Aicda促进TET介导的5hmC生成。

图6. BATF在TetE1促进TET蛋白介导的羟甲基化。
A.Batf家族(Batf1至Batf3)的平均mRNA表达(RNA-seq)。
B和C.BATF结合与5hmC富集相关。基于5hmC分布的模式将WT BATF峰分成两个簇。B簇1显示宽的5hmC分布,其中5hmC水平在活化后和不存在TET2/3时保持不变。相反,簇2中的大部分区域在活化后显示出进行性TET依赖性5hmC修饰(底部)。
D.向Aicda增强剂招募BATF和其他转录因子。
E.在TetE1进行5hmC修改需要BATF。用LPS和IL-4活化Batf-WT和Batf-KO B细胞4天,使用AbaSI-qPCR定量TetE1处的5hmC修饰
BATF强烈地结合Aicda基因座中的TetE1和TetE2增强子,并且在较小程度上结合位于TetE1和TetE2之间的-21kb基因间增强子(图6D,72小时WT和DKO;第二和第三轨迹) 。与未刺激细胞中缺乏BATF表达一致,在0小时时Aicda增强子的BATF占有率没有增加(图6D,0小时WT;顶部轨迹)。该结合模式类似于TET2(图5A),以及E2A和PU.1(图6D)。为了确定BATF是否作用于TET的上游,分析了WT和Batf缺陷B细胞中TET反应元件TetE1的5hmC沉积。发现,BATF的缺失在TetE1处消除了活化诱导的羟甲基化(图6E)。我们的结果与以下假设一致:BATF促进TET2和/或TET3向TetE1和TetE2的募集,并通过在这些上游Aicda增强子处促进5hmC修饰和DNA去甲基化来增加Aicda表达。如上所述,BATF对于Aicda调节是必需的。但是不能排除其他转录因子(包括其他bZIP家族成员)参与此过程。